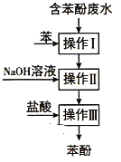
题目内容
【题目】I.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:________(填元素符号),
(2)在最高价氧化物对应的水化物中,碱性最强的化合物是________(填化学式),在常温下该化合物和元素⑦的单质反应的离子方程式__________。
(3)用电子式表示元素④与⑥的化合物的形成过程:__________。
(4)表示①与⑦的化合物的电子式_______,该化合物是由______(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是____________(用化学式表示)。
II.①CBr2;②H2O;③NH4Cl;④H2O2;⑤Na2O2;⑥Ca(OH)2;⑦HClO;⑧I2;⑨He
只含有离子键的是(用序号回答)_____,即含离子键又含共价键是(用序号回答)_____,其中含有非极性共价键的共价化合物是(用序号回答)_____,常温时为固体,当其熔化时,不破坏化学键的是(用序号回答)_____。
【答案】Ar KOH Cl2+2OH-=Cl-+ClO-+H2O ![]()
 极性 S2->Cl->O2- ① ③⑤⑥ ④ ⑧
极性 S2->Cl->O2- ① ③⑤⑥ ④ ⑧
【解析】
I.根据元素在周期表的位置可知:①是C元素,②是N元素,③是O元素,④是Na元素,⑤是Al元素,⑥是S元素,⑦是Cl元素,⑧是Ar元素,⑨是K元素,⑩是Br元素,然后根据元素周期律分析解答;
II.根据构成物质元素的金属性、非金属性强弱判断物质含有的化学键类型,结合各物质的构成微粒及微粒间的作用力判断物质熔化时破坏的作用力。
I.根据上述分析可知:①是C,②是N,③是O,④是Na,⑤ 是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K,⑩是Br元素。
(1)同一周期中惰性气体元素的原子核外电子排布达到最外层2个或8个电子的稳定结构,化学性质不活泼,在上述元素中,化学性质最不活泼的是Ar元素;
(2)元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强,在上述元素中金属性最强的元素是K元素,所以最高价氧化物对应的水化物中,碱性最强的化合物是KOH;⑦是Cl元素,Cl2与KOH反应产生KCl、KClO、H2O,该反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)元素④与⑥形成的化合物是Na2S,该化合物为离子化合物,Na+与S2-之间通过离子键结合,用电子式表示其形成过程为:![]()
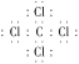
(4)①与⑦的化合物的化学式是CCl4,由于C、Cl都是非金属元素,两种元素的原子间以共价键形成共价化合物,其电子式为: ;C、Cl是不同的元素,C-Cl键为极性共价键;
;C、Cl是不同的元素,C-Cl键为极性共价键;
(5)③、⑥、⑦三种元素形成的离子分别是O2-、S2-、Cl-,O2-核外有2个电子层,而S2-、Cl-的核外有3个电子层,由于离子核外电子层数越多,离子半径越大;对于电子层结构相同的离子,核电荷数越大,离子半径越小,因此这三种离子半径由大到小的顺序是:S2->Cl->O2-;
II. ①CaBr2是离子化合物,只含有离子键,常温呈固态,熔化时破坏离子键;②H2O是共价化合物,只含极性共价键,常温呈液态;③NH4Cl是离子化合物,含有离子键、极性共价键,常温呈固态,熔化时破坏离子键;④H2O2是共价化合物,含极性共价键、非极性共价键,常温呈液态;⑤Na2O2是离子化合物,含离子键、非极性共价键,常温呈固态,熔化时破坏离子键;⑥Ca(OH)2是离子化合物,含离子键、极性共价键,常温呈固态,熔化时破坏离子键;⑦HClO是共价化合物,含极性共价键,熔化时破坏分子间作用力;⑧I2是非金属单质,含有非极性共价键,在室温下呈固态,熔化时破坏分子间作用力;⑨He是单原子分子,无化学键,常温呈气态;
综上所述可知:只含有离子键的是①,既含有离子键又含有共价键的是③⑤⑥,含有非极性共价键的共价化合物是④;常温时为固体,当其熔化时,不破坏化学键的物质是⑧。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表所列各组物质中,物质之间通过一步反应不能实砚如下图所示转化的是
选项 | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A. A B. B C. C D. D