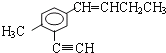
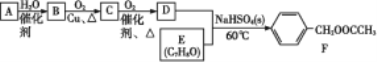
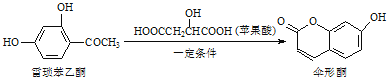题目内容
【题目】下列说法中正确的是( )
A.SO2的水溶液能导电,故SO2为电解质
B.阳离子在反应中只能得电子被还原作氧化剂
C.标准状况下,6.72L的NH3的物质的量为0.3mol
D.氯水、液氨、空气、盐酸都是混合物
【答案】C
【解析】
A.SO2的水溶液能导电是因为SO2和水反应生成了电解质亚硫酸,亚硫酸在溶液中能导电,但SO2自身不能导电,为非电解质,故A错误;
B.多价态的金属阳离子若处于中间价态,在反应中既可以被还原作氧化剂又可以被氧化作还原剂,如Fe2+,化合价既可以升高也可以降低,既可以作还原剂,也可以作氧化剂,故B错误;
C.标准状况下,NH3为气态,6.72L的NH3的物质的量为:![]() =0.3mol,故C正确;
=0.3mol,故C正确;
D.氯水、空气、盐酸都是混合物,液氨为液态的氨气,属于纯净物,故D错误;
答案选C。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】I.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:________(填元素符号),
(2)在最高价氧化物对应的水化物中,碱性最强的化合物是________(填化学式),在常温下该化合物和元素⑦的单质反应的离子方程式__________。
(3)用电子式表示元素④与⑥的化合物的形成过程:__________。
(4)表示①与⑦的化合物的电子式_______,该化合物是由______(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是____________(用化学式表示)。
II.①CBr2;②H2O;③NH4Cl;④H2O2;⑤Na2O2;⑥Ca(OH)2;⑦HClO;⑧I2;⑨He
只含有离子键的是(用序号回答)_____,即含离子键又含共价键是(用序号回答)_____,其中含有非极性共价键的共价化合物是(用序号回答)_____,常温时为固体,当其熔化时,不破坏化学键的是(用序号回答)_____。