题目内容
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。
(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。

在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
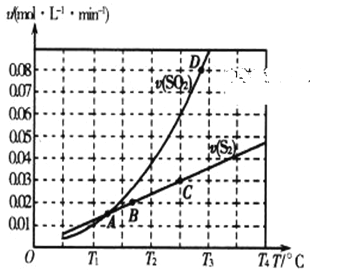
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时,将含SO2的烟气通入一定浓度的氨水中,当溶液显中性时,溶液中的![]() =_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
=_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
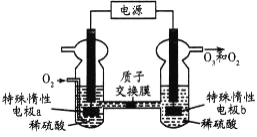
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8,请写出电解NH4HSO4溶液的化学方程式_______________。
【答案】CH4(g)+2SO2(g)=2S(g)+CO2(g)+2H2O(g) △H=+352 kJ·mol-1 C < A 0.62 2NH4HSO4 ![]() (NH4)2S2O8+H2↑
(NH4)2S2O8+H2↑
【解析】
(1)根据图像信息结合盖斯定律进行推算;
(2) ①达到平衡状态时,不同物质表示的正逆反应速率之比等于化学计量数之比,据此进行判断;
②从图像可出,升高温度,SO2的生成速率增加较快,反应逆向移动,该反应为放热反应,△H<0;
③A、针对于可逆反应2C(s)+2SO2(g)![]() S2(g)+2CO2(g),△H<0;降低温度,平衡右移,SO2平衡转化率增大;
S2(g)+2CO2(g),△H<0;降低温度,平衡右移,SO2平衡转化率增大;
B、C为纯固体,改变其用量,速率不变,平衡不移动,SO2平衡转化率不变;
C、减小容器体积,增大压强,平衡左移,SO2平衡转化率减小;
D、添加高效催化剂,只能加快反应速率,平衡不动,SO2平衡转化率不变;
(3)根据电离平衡常数的公式进行计算,Ka2(H2SO3)=![]() ,
,![]() =
=![]() ;
;
(4) NH4HSO4中硫元素为+6价,(NH4)2S2O8中硫元素为+7价,阳极SO42-失去电子发生氧化反应生成S2O82-,阴极H+得到电子被还原为氢气。
(1)根据图像可知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=Ea1-Ea2=126kJ/mol-928kJ/mol=-802kJ/mol;②S(s)+O2(g)=SO2(g)△H=-577 kJ/mol;根据盖斯定律可知①-②×2即得到CH4和SO2反应的热化学方程式为CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(g)△H=+352 kJ/mol;正确答案:CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(g) △H=+352 kJ/mol。
(2) ①达到平衡状态时,不同物质表示的正逆反应速率之比等于化学计量数之比;因此A点时,SO2的生成速率与S2(g)的生成速率相等,不符合化学计量数之比,没有达到平衡状态;B点时SO2的生成速率与S2(g)的生成速率不相等,但不符合化学计量数之比,没有达到平衡状态;C点SO2的生成速率与S2(g)的生成速率之比为2:1,符合化学计量数之比,达到平衡状态;D点时,SO2的生成速率与S2(g)的生成速率不是2倍关系,不符合化学计量数之比,没有达到平衡状态;答案选C;
②从图像可出,升高温度,SO2的生成速率增加较快,反应逆向移动,该反应为放热反应,△H<0;
③A、针对于可逆反应2C(s)+2SO2(g)![]() S2(g)+2CO2(g),△H<0;降低温度,平衡右移,SO2平衡转化率增大,选项A正确;
S2(g)+2CO2(g),△H<0;降低温度,平衡右移,SO2平衡转化率增大,选项A正确;
B、C为纯固体,改变其用量,速率不变,平衡不移动,SO2平衡转化率不变,选项B错误;
C、减小容器体积,增大压强,平衡左移,SO2平衡转化率减小,选项C错误;
D、添加高效催化剂,只能加快反应速率,平衡不动,SO2平衡转化率不变,选项D错误;
答案选A;
(3)25℃时,将含SO2的烟气通入该氨水中,当溶液显中性时,c(H+)=c(OH-)=10-7mol/L,亚硫酸氢根离子电离平衡常数Ka2(H2SO3)=![]() ,
,![]() =
=![]() =
=![]() =0.62;
=0.62;
() NH4HSO4中硫元素为+6价,(NH4)2S2O8中硫元素为+7价,阳极SO42-失去电子发生氧化反应生成S2O82-,阴极H+得到电子被还原为氢气,电解NH4HSO4溶液的化学方程式2NH4HSO4![]() (NH4)2S2O8+H2↑;正确答案:2NH4HSO4
(NH4)2S2O8+H2↑;正确答案:2NH4HSO4![]() (NH4)2S2O8+H2↑。
(NH4)2S2O8+H2↑。