题目内容
【题目】祖母绿是四大名贵宝石之一,主要成分为Be3Al2Si6O18,含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)基态Ni2+的电子排布式为_______________;宝石中Si的杂化方式是____。
(2)成键元素电负性差值越大,化学键离子性百分数越高,在卤素与Al组成的化合物中,离子性百分数最高的化合物是______(填化学式)。
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是______,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的作用力类型为_________。
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用Δ表示),它与中心离子的结构、电荷、配体有关。试判断分裂能Δ[Fe(H2O)63+] _____ Δ[Fe(H2O)62+](填“>”“<”或“=”),理由是___________________________。
(5)①氧化镍晶胞如图甲所示,A的原子坐标参数为:(0,0,![]() ),则底面面心B的原子坐标参数为_______________。
),则底面面心B的原子坐标参数为_______________。

②按图乙所示无限拓宽延长,NiO可形成“单层分子”,氧离子和镍离子均看着球体,其半径分别为a pm、b pm,“单层分子”截割出的最小重复结构单元在空间呈长方体,则离子在长方体内的空间利用率为____________(列出计算式即可)。
【答案】1s22s22p63s23p63d8(或[Ar]3d8) sp3 AlF3 分子晶体 配位键 > Fe3+的正电荷数比Fe2+的多,吸引电子能力更强;Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构 (![]() ,
,![]() ,0)
,0) 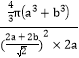 ×100%=
×100%=![]() ×100%=
×100%=![]() ×100%
×100%
【解析】
(1)镍为28号元素,结合核外电子排布规律书写基态Ni2+的电子排布式;Si原子与周围的4个原子形成共价键,没有孤电子对,据此判断硅原子的杂化方式;
(2)根据成键元素电负性差值越大,化学键离子性百分数越高,元素的非金属性越强,电负性数值越大,据此分析解答;
(3)根据六羰基铬[Cr(CO)6]的沸点为220℃,分析判断;加热Cr(CO)6可得到高纯度铬粉和CO,反应过程中破坏了中心原子与配体之间的作用力;
(4)配离子所带正电荷越多,对电子的吸引力越大,d-d电子跃迁需要的能量越多;
(5)①图甲中A位于晶胞棱的中点,据此判断底面面心B的原子坐标参数;
②图乙中,该晶胞单元中含有氧离子个数=10,镍离子个数为4+4×![]() +10×
+10×![]() =10,相邻两个氧离子之间的距离为
=10,相邻两个氧离子之间的距离为![]() (2a+2b) pm,据此分析计算。
(2a+2b) pm,据此分析计算。
(1)镍为28号元素,基态Ni2+的电子排布式为1s22s22p63s23p63d8(或[Ar]3d8);Si原子与周围的4个原子形成共价键,没有孤电子对,杂化方式为sp3,故答案为:1s22s22p63s23p63d8(或[Ar]3d8);sp3;
(2)成键元素电负性差值越大,化学键离子性百分数越高,元素的非金属性越强,电负性数值越大,在卤素与Al组成的化合物中,离子性百分数最高的化合物为AlF3,故答案为:AlF3;
(3)六羰基铬[Cr(CO)6]的沸点为220℃,符合分子晶体熔沸点的一般规律,Cr(CO)6属于分子晶体;加热Cr(CO)6可得到高纯度铬粉和CO,反应过程中破坏了中心原子与配体之间的配位键,故答案为:分子晶体;配位键;
(4)Fe(H2O)62+带2个单位正电荷,而Fe(H2O)63+带3个单位正电荷,后者对电子吸引力更大,且Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构,故分裂能△[Fe(H2O)63+]>△[Fe(H2O)62+],故答案为:>;Fe(H2O)62+带2个单位正电荷,而Fe(H2O)63+带3个单位正电荷,后者对电子吸引力更强,Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构;
(5)①图甲中,原子坐标参数:A(0,0,![]() ),A位于晶胞棱的中点,则底面面心B的原子坐标参数为B(
),A位于晶胞棱的中点,则底面面心B的原子坐标参数为B(![]() ,
,![]() ,0),故答案为:(
,0),故答案为:(![]() ,
,![]() ,0);
,0);
②图乙中,该晶胞单元中含有氧离子个数=10,镍离子个数为4+4×![]() +10×
+10×![]() =10,相邻两个氧离子之间的距离为
=10,相邻两个氧离子之间的距离为![]() (2a+2b) pm,则晶胞的棱长分别为5×
(2a+2b) pm,则晶胞的棱长分别为5×![]() (2a+2b)pm和2×
(2a+2b)pm和2×![]() (2a+2b)pm,高为2a pm,则晶胞的体积为5×
(2a+2b)pm,高为2a pm,则晶胞的体积为5×![]() (2a+2b)pm×2×
(2a+2b)pm×2×![]() (2a+2b) pm×2a pm=10a(2a+2b)2 pm3,10个氧离子和10个镍离子的体积为10×
(2a+2b) pm×2a pm=10a(2a+2b)2 pm3,10个氧离子和10个镍离子的体积为10×![]() pm3,因此离子在长方体内的空间利用率为
pm3,因此离子在长方体内的空间利用率为![]() ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

 阅读快车系列答案
阅读快车系列答案【题目】PbCO3可用于油漆、陶瓷和玻璃等工业。由方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2)制备PbCO3的流程如下:

已知:PbCl2难溶于冷水和乙醇,易溶于热水;各物质的溶度积见下表。试回答下列问题:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
Ksp | 2×10-13 | 8.0×10-16 | 1×10-38 | 1.6×10-5 | 8.0×10-28 | 7.4×10-14 |
(1)PbCO3的名称是________。
(2)步骤①中MnO2的作用是________,根据下图分析①的最佳反应条件是________。

(3)步骤②趁热抽滤的原因是___________________。
(4)步骤③洗涤用的试剂是____________。
(5)将滤液Y先酸化,然后加入MnO2,反应的离子方程式为__________;若反应后c(Mn2+)=0.2mol/L,进一步调节溶液的pH可分离Fe3+和Mn2+,溶液所调的pH范围为_______[c(Fe3+)≤1×10-5 mol/L时表示Fe3+已沉淀完全]。
(6)步骤④反应的离子方程式为______________。
(7)样品PbCO3中有少量PbCl2杂质,提纯的实验方案是________。