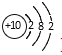题目内容
【题目】(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
以下为废水中铬元素总浓度的测定方法:_______________________
准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 mL。计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O===Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+===2Cr3++3I2+7H2O
③I2+2S2O32-===2I-+S4O62-
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3·5H2O)纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为:2S2O32-+I2===S4O62-+2I-

①滴定至终点时,溶液颜色的变化:________。
②滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
【答案】0.735 0③⑦由方程式确定关系式:Cr~3Na2S2O3,然后进行计算。
n(S2O32-)=0.02 L![]() 0.015 mol·L-1=3
0.015 mol·L-1=3![]() 10-4mol
10-4mol
n(Cr)=1![]() 10-4mol
10-4mol
m(Cr)=1![]() 10-4mol
10-4mol![]() 52 g·mol-1=5.2
52 g·mol-1=5.2![]() 10-3g=5.2 mg
10-3g=5.2 mg
废水中铬元素总浓度=5.2mg/0.025L=208 mg·L-1由无色变蓝色,半分钟内不褪色18.10(3.620×10-3M)/W×100%
【解析】
根据m=nM=cVM得:m(K2Cr2O7)=0.01000mol·L-1×0.250L×294.0g·mol-1=0.7350g,配置一定物质的量浓度的溶液,一般电子天平用于称量固体质量,烧杯用于溶解固体,用玻璃棒搅拌,加速溶解,用玻璃棒引流,将溶液移入容量瓶中,继续加水至离刻度线1~2cm处,改用胶头滴管加水定容,所以用不到的仪器为量筒和移液管,故③⑦用不到,故选③⑦。
(2)由①2Cr3++3S2O82-+7H2O===Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+===2Cr3++3I2+7H2O ③I2+2S2O32-===2I-+S4O62-
可得关系式:,2Cr3+![]() Cr2O72-
Cr2O72-![]() 6I-
6I-![]() 6S2O32-
6S2O32-
n(Na2S2O3)= 0.015 mol·L-1![]() 20.00 mL=3
20.00 mL=3![]() 10-4mol,则n(Cr3+)= 3
10-4mol,则n(Cr3+)= 3![]() 10-4mol
10-4mol
m(Cr)= 1![]() 10-4mol
10-4mol![]() -1=5.2
-1=5.2![]() 10-3g=5.2mg
10-3g=5.2mg
废水中铬元素总浓度c=5.2mg/0.025L=208 mg·L-1。答案:铬元素总浓度208 mg·L-1。
(3)①滴定结束后,碘单质使淀粉变蓝,所以滴定终点时溶液颜色变化是由无色变蓝色,半分钟内不褪色;
②根据图示的滴定管中液面可知,滴定管中初始读数为0,滴定终点液面读数为18.10mL,所以消耗碘的标准溶液体积为18.10mL;
根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以Wg产品中含有Na2S2O35H2O质量为:0.1000 molL-1×18.10×10-3L×2×M=3.620×10-3Mg,则产品的纯度为:(3.620×10-3M)/W×100%。

 名校课堂系列答案
名校课堂系列答案