题目内容
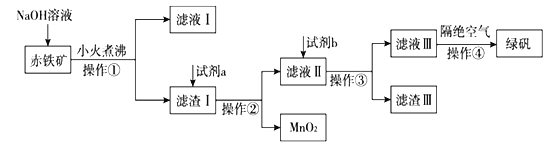
【题目】为了将混有Na2SO4、NH4HCO3的NaCl提纯。某学习小组设计了如图所示的方案:
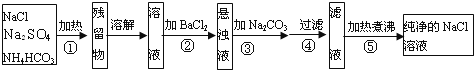
(1)操作①盛放药品的仪器名称是___________,发生反应的化学反应方程式为__________________。
(2)进行操作②后,如何判断杂质是否除尽?_______________________________________________。
(3)操作③的目的是_____________________。
(4)请你评价该设计方案设计是否严密?若不严密,请说明理由,并提出改进方案_______________。
【答案】坩埚 NH4HCO3![]() NH3 ↑+ CO2↑+ H2O 取上层清液,滴加BaCl2溶液,无沉淀生成,说明杂质已除净 除去过量的Ba2+ 不严密,混有杂质Na2CO3,应加入适量盐酸,再加热煮沸
NH3 ↑+ CO2↑+ H2O 取上层清液,滴加BaCl2溶液,无沉淀生成,说明杂质已除净 除去过量的Ba2+ 不严密,混有杂质Na2CO3,应加入适量盐酸,再加热煮沸
【解析】
混有硫酸钠、碳酸氢铵的氯化钠固体,由流程可知,①中在生加热条件下碳酸氢铵发生分解反应变为气体逸出,分解后的固体溶于水,与氯化钡反应可除去硫酸根离子,再利用碳酸钠除去过量的钡离子,过滤后的滤液中含NaCl、碳酸钠,再加过量的盐酸就可除去碳酸钠,反应后溶质为NaCl、HCl,通过蒸发就能得到纯净的NaCl,以此来解答。
(1)将固体混合物加热是在坩埚中进行的;碳酸氢铵不稳定,加热分解,反应化学方程式是: NH4HCO3![]() NH3 ↑+ CO2↑+ H2O;
NH3 ↑+ CO2↑+ H2O;
(2)向Na2SO4、NaCl混合溶液中加入过量氯化钡溶液,发生反应:Ba2++SO42-=BaSO4↓;若硫酸根离子被除尽,那么再加入硝酸钡溶液时,就不会产生沉淀。通过取过滤后的上层清液,向其中滴加BaCl2溶液,若无沉淀生成,说明杂质已除净;
(3)操作②加入过量的氯化钡溶液可将SO42-除尽,但又引入了杂质离子Ba2+,操作③加入碳酸钠溶液时,碳酸钠就可与过量的氯化钡发生沉淀反应生成碳酸钡沉淀,从而可达到除去过量杂质Ba2+的目的;
(4)加入过量的碳酸钠溶液,可以除去溶液中过量的Ba2+,但同时又引入了新的杂质Na2CO3。该物质加热不反应,不能去除,因此此设计方案不严密,正确操作方法为在操作③加过量的Na2CO3溶液反应后过滤除去BaCO3沉淀,在操作④之后再向滤液中加过量盐酸,盐酸与碳酸钠反应,除去Na2CO3,最后通过加热煮沸除去HCl,就可得到纯净的NaCl溶液。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案