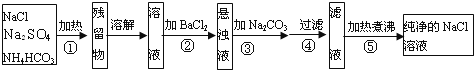
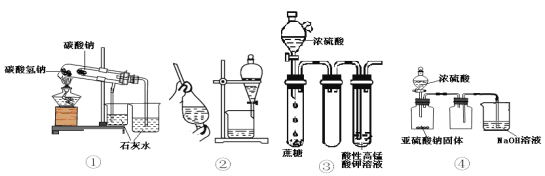
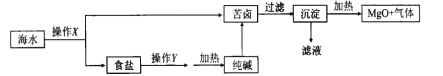
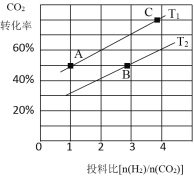
题目内容
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V (已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是
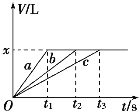
A. x=2.24 B. 曲线b为Mg与盐酸反应的图象
C. 反应时,Na、Mg、Al均过量 D. 钠的物质的量为0.2 mol
【答案】C
【解析】
金属性强弱:Na>Mg>Al,钠是活泼金属,能于水反应,与盐酸反应速率最快,Mg、Al与水不反应,只能与盐酸反应,依据金属性强弱,反应速率快慢顺序是a>b>c,因此a表示Na,B表示Mg,c表示Al,根据图像可知,反应中生成氢气体积相同,参加反应的盐酸是相同,即盐酸完全反应,金属钠不过量。
金属性强弱:Na>Mg>Al,钠是活泼金属,能于水反应,与盐酸反应速率最快,Mg、Al与水不反应,只能与盐酸反应,依据金属性强弱,反应速率快慢顺序是a>b>c,因此a表示Na,B表示Mg,c表示Al,根据图像可知,反应中生成氢气体积相同,参加反应的盐酸是相同,即盐酸完全反应,金属钠不足,
A、确定氢气的体积,从Na与盐酸反应进行计算得到,2Na+2HCl=2NaCl+H2↑,盐酸恰好完全反应,即V(H2)=100×10-3L×2mol·L-1×22.4L·mol-1/2=2.24L,故A说法正确;
B、根据上述分析,曲线b为Mg与盐酸反应的图像,故B说法正确;
C、根据上述分析,Na与盐酸反应不足,依据A选项,求出Na的物质的量为0.2mol,即Mg、Al物质的量为0.2mol,Mg、Al过量,故C说法错误;
D、根据C选项分析,Na的物质的量为0.2mol,故D说法正确。

【题目】某实验小组同学做中和滴定和中和热的测定两个实验。
Ⅰ.下图是该小组同学用0.5000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和第1次滴定前、后盛放盐酸的滴定管中液面的位置。请回答下列问题。

(1)仪器A的名称是_______________。
(2)第1次滴定消耗标准液_________mL 。
(3)已知每次滴定操作所取待测NaOH溶液的体积均为20.00mL。第2、3、4次滴定数据如下表所示。通过计算得待测NaOH溶液的平均浓度是___________mol/L。(保留四位有效数字)
实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
2 | 20.00 | 1.20 | 21.20 |
3 | 20.00 | 2.24 | 22.26 |
4 | 20.00 | 1.50 | 21.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.向锥形瓶里注入20.00 mL待测NaOH溶液,并滴入2-3滴酚酞;
B.用标准溶液润洗酸式滴定管2-3次;
C.固定好装标准溶液的酸式滴定管,调节滴定管尖嘴使之充满溶液,管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2-3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准HCl溶液滴定至终点并记下滴定管液面刻度。
合理的操作顺序是(用序号字母填写)______________________________。
(5)如何判断到达滴定终点?_________________________________________。
(6)如果上述B步骤省略,对测定结果的影响是_________;标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是______(填“无影响”、“偏高”、“偏低”)。
Ⅱ.现用上述盐酸和已测出浓度的NaOH溶液,设计如下装置测定中和热。
将50mL盐酸与50mL NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(7)从图示看此装置存在错误,请指出_________________。
(8)当室内温度低于10℃时,对实验数据影响很大,实验测得的中和热数值偏小。其原因是___________________。
(9)如果实验测得起始温度为t1℃,反应后的最高温度为t2℃,则中和热的表达式为ΔH =___________。(中和后溶液的比热容c=4.18J/(g.℃))
(10)本次实验室内温度正常,操作无误,但是数据偏低,其原因是_________________。