题目内容
【题目】(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,用离子方程式解释其目的__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,请你代表乙组发表改进方案_____________。
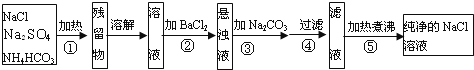
(二)工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
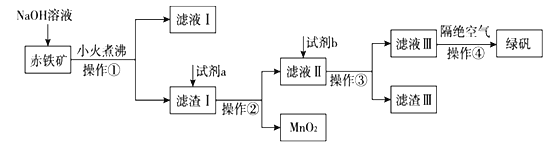
(4)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________________________。
(5)向滤渣Ⅰ中加入过量的试剂a为___________,加入过量试剂b后所得滤渣Ⅲ的主要成分为______。
(6)操作③需要的玻璃仪器主要包括_______________。
(7)操作④需要隔绝空气的主要原因可能是什么?______________________________________。
【答案】2Fe3++Fe=3Fe2+ 2Fe2++ Cl2=2Fe3++2Cl- 在FeCl2溶液的液面上覆盖一层煤油,就可以使溶液与空气隔离,排除氧气对实验的影响; Al2O3+2OH-=2AlO2-+ H2O、SiO2+2OH-=SiO32-+ H2O 稀硫酸 铁和铜 漏斗、玻璃棒、烧杯 防止硫酸亚铁被氧化
【解析】
(一)铁和氯化铁反应生成氯化亚铁,氯气与氯化亚铁反应产生氯化铁;利用SCN-与Fe3+反应产生血红色溶液检验Fe3+;煤油不溶于水,密度比水小,可以隔离溶液与空气接触,排除氧气对实验的影响。
(二)赤铁矿加NaOH后,Al2O3、SiO2与NaOH反应,则滤液I中含OH-、AlO2-、SiO32-,滤渣I中含Fe2O3、FeO、MnO2、CuO,加试剂a为硫酸,操作①②均为过滤,滤液Ⅱ中含硫酸、Fe2(SO4)3、FeSO4、CuSO4,试剂b为Fe,操作③为过滤,滤渣Ⅲ为Cu、Fe,滤液Ⅲ含FeSO4,蒸发浓缩、冷却结晶可得到绿矾,以此来解答。
(1)在FeCl2溶液中加入少量铁屑,铁和氯化铁反应生成氯化亚铁,就可以防止硫酸亚铁溶液变质,反应的方程式是2Fe3++Fe=3Fe2+;
(2)氯气具有氧化性,能氧化氯化亚铁为氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-,反应产生的Fe3+遇SCN-生成血红色物质,使溶液变为红色,因此可用KSCN溶液检验氯气能否氧化FeCl2;
(3)由于空气中的氧气可以溶解在FeCl2溶液中,而氧化FeCl2,所以甲同学方案不严谨,改进方案是在FeCl2溶液的液面覆盖一层煤油。由于煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,从而排除氧气对实验的影响;
(4)NaOH溶液加入赤铁矿中,与氧化铝、二氧化硅发生反应,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O;
(5) Fe2O3、FeO、MnO2、CuO不能与NaOH反应,进入滤渣I,为制取硫酸亚铁,向滤渣I中加入试剂a为硫酸,氧化物中的Fe2O3、FeO、CuO与硫酸反应,产生Fe2(SO4)3、CuSO4、FeSO4,MnO2不能反应,以固体形式存在,过滤得滤液II,试剂b为Fe,将足量的Fe投入到滤液Ⅱ中,发生反应Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+、Fe+2H+=H2↑+Fe2+。置换出的Cu及过量的Fe通过过滤进入滤渣III中,所以滤渣Ⅲ主要成分铁和铜;
(6)分离难溶性固体和溶液采用过滤方法,需要的玻璃仪器主要包括漏斗、玻璃棒、烧杯;
(7) Fe2+不稳定,易被空气氧化生成Fe3+,所以操作④隔绝空气的目的是防止溶液中的Fe2+被空气氧化为Fe3+。