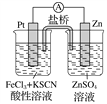
题目内容
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大。其中A元素原子的核外p电子数比s电子数少1。C是电负性最大的元素。D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素。
(1)写出基态C原子的电子排布式_________________。
(2)A、B、C三种元素的第一电离能由大到小的顺序为______________(用元素符号表示),原因是___________________。
(3)已知DC4常温下为气体,则该物质的晶体类型是_________,组成微粒的中心原子的轨道杂化类型为____________,空间构型是___________。
(4)Cu2+容易与AH3形成配离子[Cu(AH3)4]2+,但AC3不易与Cu2+形成配离子,其原因是______________________。
(5)A、B两元素分别与D形成的共价键中,极性较强的是__________。A、B两元素间能形成多种二元化合物,其中与A3—互为等电子体的物质的化学式为__________。
(6)已知E单质的晶胞如图所示,则晶体中E原子的配位数为__________,一个E的晶胞质量为___________。

【答案】1s22s22p5F>N>ON 原子的2p 能级处于较稳定的半充满状态分子晶体sp3正四面体形由于电负性F>N>H,在NF3 分子中,共用电子对偏向F 原子,使得N 原子上的孤电子对难与Cu2+形成配位键Si-O 键N2O8112/NA g
【解析】
A元素原子的核外p电子数比s电子数少1,A的核外电子排布为:1s22s22p3,所以是氮元素,C是电负性最大的元素是氟元素,D原子次外层电子数是最外层电子数2倍,为硅元素,E是第Ⅷ族中原子序数最小的元素是铁元素,而A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大,所以元素B是氧元素。
(1)C为F,基态C原子的电子排布式1s22s22p5。
(2)A、B、C三种元素的第一电离能由大到小的顺序为F>N>O (用元素符号表示),原因是N 原子的2p 能级处于较稳定的半充满状态故N>O,F最大。
(3)已知DC4即四氟化硅常温下为气体,则该物质的晶体类型是分子晶体,组成微粒的中心原子的轨道杂化类型为sp3,空间构型是正四面体形。
(4)Cu2+容易与AH3形成配离子[Cu(AH3)4]2+,但NF3分子中,共用电子对偏向F原子,使得N原子上孤电子对难与铜离子形成配位键,其原因是由于电负性F>N>H,在NF3 分子中,共用电子对偏向F 原子,使得N 原子上的孤电子对难与Cu2+形成配位键。
(5)A、B两元素分别与D形成的共价键中,O元素的非金属性大于N,则极性O-Si键>N-Si键;等电子体中原子个数相等及价电子数相等,N3-中含有3个原子、价电子数是16,与该离子互为等电子体的氮氧化物为N2O。
(6)该晶胞是体心立方晶胞,所以铁原子的配位数为8,该晶胞中Fe原子个数=1+8×1/8=2,体心上的Fe原子被顶点上的8个原子包围,所以其配位数是8,每个Fe原子的质量=M/NAg,则该晶胞质量就是两个Fe原子质量=2×M/NAg=2×56/NAg=112/NAg。

【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是__________
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
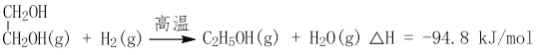
获取乙二醇的反应历程可分为如下2步:
I. 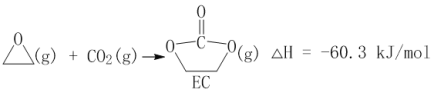
II.EC加氢能生成乙二醇与甲醇。
①步骤II的热化学方程式是__________;
②研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/℃ | EC转化率/ % | 产率/% | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是__________。温度升高到220℃时,乙二醇的产率反而降低,原因是__________
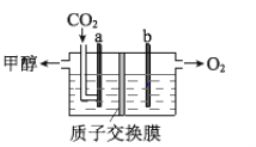
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极 a 接电源的__________极(填“正”或“负”),生成甲醇的电极反应式是__________
(4)CO2较稳定、能量低。为实现CO2的高效使用,下列研究方向合理的是__________(填序号)。
a.降低CO2参与反应的速率和比例
b.利用电能、光能或热能预先活化CO2分子
c.选择高效的催化剂降低反应条件