题目内容
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
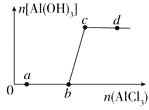
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Ag+、Ca2+、NO3-、F-
C. c点对应的溶液中:Na+、S2-、SO42-、Cl-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
【答案】C
【解析】试题分析:向一定量的NaOH溶液中逐滴加入AlCl3溶液,在b点之前没有产生沉淀,是由于发生反应:4NaOH+AlCl3=NaAlO2+NaCl+2H2O,到B点时溶液为NaAlO2和NaCl的混合溶液,然后再加入AlCl3发生反应:3NaAlO2+ AlCl3+6H2O="3NaCl+" 4Al(OH)3↓;至c点该反应恰好完全反应,溶液为NaCl。A.a点对应的溶液中含有大量的OH-,OH-与Mg2+、HCO3-发生复分解反应而不能大量存在,错误;B.b点对应的溶液中只含有NaAlO2和NaCl,若溶液中含Ag+、Ca2+、F-,会发生反应形成AgCl、CaF2沉淀;C.c点对应的溶液是NaCl,在该溶液中Na+、S2-、SO42-、Cl-不能发生任何反应,可以大量共存,正确;D.d点对应的溶液中含有NaCl、AlCl3,而Al3+与CO32-会发生双水解反应而不能大量共存,错误。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目