题目内容
【题目】H2S为二元弱酸。20℃时,向 0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是
A.pH=7的溶液中:c(Cl-)=c(HS-)+2c(H2S)
B.通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+)
C.c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
D.c(Cl-)=0.100 mol·L-1的溶液中:c(OH-)-c(H+)=c(H2S)-2c(S2-)
【答案】A
【解析】
A.电荷守恒式c(Cl-)+2c(S2-)+c(HS-)+c(OH-)=c(Na+)+c(H+),物料守恒式c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),pH=7的溶液c(OH-)=c(H+),三等式联立可得c(Cl-)=c(HS-)+2c(H2S),故A正确;
B.通入HCl气体之前,该溶液为Na2S溶液,分步水解且程度很小,离子浓度大小关系为c(S2-)>c(OH-)>c(HS-)>c(H+),故B错误;
C.c(Cl-)+c(OH-)=c(H+)+c(HS-)+2c(H2S),两边同时加上c(S2-),得c(Cl-)+c(OH-)+c(S2-)=c(H+)+c(HS-)+c(S2-)+2c(H2S),因c(HS-)=c(S2-)碱性溶液,所以c(Cl-)+c(HS-)<c(HS-)+c(S2-)+2c(H2S),又因0.100molL-1=![]() c(Na+)=c(S2-)+c(HS-)+c(H2S),所以c(Cl-)+c(HS-)<0.100 molL-1+c(H2S),故C错误;
c(Na+)=c(S2-)+c(HS-)+c(H2S),所以c(Cl-)+c(HS-)<0.100 molL-1+c(H2S),故C错误;
D.c(Cl-)=0.100 molL-1的溶液中,c(S2-)+c(HS-)+c(H2S)=c(Cl-)=0.100molL-1,又因c(Cl-)+c(OH-)=c(H+)+c(HS-)+2c(H2S),所以c(OH-)-c(H+)=c(HS-)+2c(H2S)-[c(S2-)+c(HS-)+c(H2S)]=c(H2S)-c(S2-),故D错误;
故答案为A。

【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) ΔH1
C2H4(g)+C2H6(g) ΔH1
副反应:C4H10(g,正丁烷)![]() CH4(g)+C3H6(g) ΔH2 回答下列问题:
CH4(g)+C3H6(g) ΔH2 回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量叫生成热,生成热可表示该物质相对能量。下表为25℃、101 kPa下几种有机物的生成热:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ·mol1 | 75 | 85 | 52 | 20 | 125 | 132 |
①表格中的物质,最稳定的是________________(填结构简式)。
②上述反应中,ΔH1=____________kJ·mol1。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。下列情况表明该反应达到平衡状态的是_________________(填代号)。
A.气体密度保持不变 B.![]() 保持不变
保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
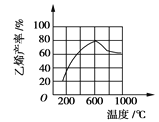
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,
随着温度升高,乙烯产率降低,可能的原因是____________(填代号)。
A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)为___________mol·L1·min1。
②上述条件下,正丁烷的平衡转化率为_____________;该反应的平衡常数K为____。
(5)丁烷空气燃料电池以熔融的K2CO3(其中不含O2和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e=6CO32-,负极反应式为____________________。