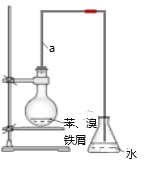
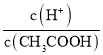题目内容
【题目】(1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
①铁锅的锈蚀是________腐蚀(填“析氢”或“吸氧”)。
②写出铁锅腐蚀正极的电极反应式:________________________________
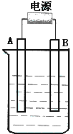
(2)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
①A接的是电源的_______极, B电极上的反应式_____________________。
②写出电解时反应的总离子方程式_____________________________________
③电解后溶液的pH为_____________ (假设电解前后溶液的体积不变);
要使电解后溶液恢复到电解前的状态,则需加入__________ 。
【答案】吸氧 2H2O+O2+4e-=4OH- 阴极 4OH--4e-=2H2O+O2↑ 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 1 CuO或CuCO3
2Cu+O2↑+4H+ 1 CuO或CuCO3
【解析】
(1)①中性或弱酸性条件下,钢铁发生吸氧腐蚀;
②铁、碳和电解质溶液构成原电池,碳作正极,正极上氧气得电子发生还原反应;
(2)②电解可溶性的铜盐的实质是电解盐和水,根据电极反应书写电解方程式;
③根据电解后所得溶液中氢离子的浓度计算溶液的pH,电解后溶液复原,遵循的原则是:出什么加什么。
(1)①弱酸或中性条件下,钢铁发生吸氧腐蚀,故答案为:吸氧;
②铁、碳和电解质溶液构成原电池,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;
(2)①电解液是蓝色溶液,A电极表面有红色的固态物质生成,所以A极是铜离子得电子,所以A极是阴极,A接的是电源的负极,B电极有无色气体生成,则一定是氢氧根失电子产生的氧气,电极方程式为4OH--4e-=2H2O+O2↑;
②阴极反应:2Cu2++4e-=2Cu,阳极反应:4OH--4e-=2H2O+O2↑,电解时反应的总离子方程式为:2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③取出A电极,洗涤、干燥、称量、电极增重1.6g,所以阴极析出金属铜的质量是1.6g,即0.025mol,所以生成氢离子的物质的量为0.05mol,所以![]() ,则pH=1,电解后析出了金属铜和有氧气放出,所以要想溶液复原,需加入 CuO或CuCO3。
,则pH=1,电解后析出了金属铜和有氧气放出,所以要想溶液复原,需加入 CuO或CuCO3。

【题目】已知![]() 时,
时,![]() 、HCN和
、HCN和![]() 的电离常数如表:
的电离常数如表:
| HCN |
|
|
|
|
下列有关叙述错误的是![]()
A.向NaCN溶液中通入少量![]() 的离子方程式:
的离子方程式:![]()
B.![]() 时,反应
时,反应![]() 的化学平衡常数为
的化学平衡常数为![]()
C.中和等体积、等物质的量浓度的![]() 和HCN溶液,消耗NaOH的量前者小于后者
和HCN溶液,消耗NaOH的量前者小于后者
D.等物质的量浓度的![]() 和NaCN混合溶液中:
和NaCN混合溶液中:![]()