题目内容
元素的性质呈周期性变化的根本原因是( )
| A.随着元素相对原子质量的递增,量变引起质变 |
| B.元素的原子半径呈周期性变化 |
| C.元素原子核外电子排布呈周期性变化 |
| D.元素的金属性和非金属性呈周期性变化 |
C
解析试题分析:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。元素原子的核外电子排布的周期性变化导致元素性质(金属性和非金属性,原子半径,化合价等)的周期性变化;选C。
考点:考查元素周期律。

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法不正确的是
| A.原子半径的大小顺序:r(W)>r(Y)>r(Z)>r(X) |
| B.元素Z、W 的简单离子的电子层结构相同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
X、Y、Z、M、W为短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L;W的质子数是X、Y、Z、M四种元素质子数之和的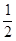 。下列说法正确的是
。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.由X元素形成的单质不一定是原子晶体 |
| C.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
四种短周期元素在元素周期表中的位置如右图所示,其中Z的原子半径最小。下列说法正确的是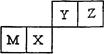
| A.M元素一定为金属元素 |
| B.X元素的最简单气态氢化物的热稳定性比Z元素的大 |
| C.若Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱 |
| D.Z元素与氢元素一定能形成原子个数比为1︰1的共价化合物 |
如图表示1~18号元素原子的结构或性质随核电荷数递增的变化。图中纵坐标表示
| A.电子层数 | B.原子半径 | C.最高化合价 | D.最外层电子数 |
类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是
| A.SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高 |
| B.钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂 |
| C.Al(OH)3能溶于NaOH溶液,则Be(OH)2能溶于NaOH溶液 |
| D.甲酸甲酯能发生银镜反应,则乙酸甲酯能发生银镜反应 |
六种短周期元素(a、b、c、d、e、f)的原子序数依次增大。其中a与e同主族,b与f同主族,e与f同周期;常温下a、e的单质状态不同;d的核电荷数是b的最外层电子数的2倍;单质f是一种重要的半导体材料。由此可推知
| A.a、c两种元素只能组成化学式为ca3的化合物 |
| B.b、c、d分别与a形成的化合物,沸点由高到低依次为:d>c>b |
| C.原子半径由大到小的顺序是 e>f>b>c>a |
| D.元素的非金属性由强到弱的顺序是 d>c>f>b |
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是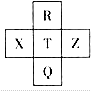
| A.非金属性:Z>T>X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R<T<Q |
| D.R、T、Q的最高正价相同 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )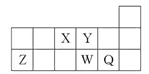
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q) |
| C.离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| D.元素W的最高价氧化物对应的水化物的酸性比Q的强 |