题目内容
X、Y、Z、M、W为短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L;W的质子数是X、Y、Z、M四种元素质子数之和的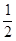 。下列说法正确的是
。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.由X元素形成的单质不一定是原子晶体 |
| C.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
B
解析试题分析:X、Y、Z、M、W分别为C、N、O、H、Na;原子半径:Na>C>N>O>H,A选项错误,C60是分子晶体,B选项正确,过氧化钠是离子化合物,C选项错误,四种元素形成氨基酸如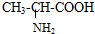 ,只有共价键,D选项错误。
,只有共价键,D选项错误。
考点:考查元素推断。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素,下列说法正确的是( )
| A.原子半径的大小顺序: r(Y)>r(Z)>r(W) |
| B.元素Z、W的简单离子的电子层结构不同 |
| C.元素Y的简单气态氢化物的热稳定性比Z的强 |
| D.只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
下图为元素周期表中短周期的一部分,下列说法错误的是
| X | Y |
| Z | W |
B.单质的活泼性可能是Y<Z
C.X、Z的最高价氧化物对应水化物可能均为强酸
D.分别由Y、W形成的单质可能都是原子晶体
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是
| A.②、⑧、⑨对应简单离子半径依次减小 |
| B.⑥的氯化物的熔点比⑦的氯化物熔点低 |
| C.元素⑩处于常见周期表第四周期第VIIIB族 |
| D.①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
元素的性质呈周期性变化的根本原因是( )
| A.随着元素相对原子质量的递增,量变引起质变 |
| B.元素的原子半径呈周期性变化 |
| C.元素原子核外电子排布呈周期性变化 |
| D.元素的金属性和非金属性呈周期性变化 |
下列表示氮原子结构的化学用语中,对核外电子运动状态描述正确且能据此确定电子的能级的是
A.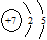 | B.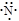 | C.1s22s22p3 | D.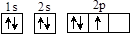 |
下列排列顺序不正确的是
| A.热稳定性:H2O>NH3>PH3 | B.原子半径:Si>Na>O |
| C.碱性:CsOH>KOH>NaOH | D.失电子能力:K>Na>Mg |
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )。
| A.只由这四种元素不能组成有机化合物 |
| B.最高价氧化物对应的水化物的酸性W比Z弱 |
| C.Z的单质与氢气反应较Y剧烈 |
| D.X、Y形成的化合物都易溶于水 |