题目内容
四种短周期元素在元素周期表中的位置如右图所示,其中Z的原子半径最小。下列说法正确的是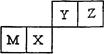
| A.M元素一定为金属元素 |
| B.X元素的最简单气态氢化物的热稳定性比Z元素的大 |
| C.若Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱 |
| D.Z元素与氢元素一定能形成原子个数比为1︰1的共价化合物 |
D
解析试题分析:A.若Z是F,则Y是O,X是P,M是Si,Si是非金属元素。错误。B.元素的非金属性越强,其对应的氢化物稳定性就越强。在元素周期表中同一周期的元素,从左到右,元素的非金属性逐渐增强;在同一主族中,从上到下,元素的非金属性逐渐减弱。所以非金属性Z>X,所以Z的氢化物稳定性比X的强。错误。C.同理非金属性Y>X,元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强。所以Y元素的最高价含氧酸的酸性比X元素的最高价含氧酸强。错误。D.由于Z的非金属性最强,为F,所以它与H形成原子个数比为1︰1的化合物HF为共价化合物。最强。
考点:考查元素的推断及元素与化合物的性质的知识。

练习册系列答案
相关题目
不能比较氮和氧非金属性相对强弱的是
| A.氨气在氧气中燃烧生成氮气 | B.沸点:H2O>NH3 |
| C.NO中N为+2价,氧为-2价 | D.热稳定性:H2O>NH3 |
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是
| A.②、⑧、⑨对应简单离子半径依次减小 |
| B.⑥的氯化物的熔点比⑦的氯化物熔点低 |
| C.元素⑩处于常见周期表第四周期第VIIIB族 |
| D.①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
下列各组物质的性质比较中不正确的是
| A.热稳定性:SiH4>PH3>H2 S |
| B.酸性:HClO4>H2SO4>H3 PO4 |
| C.碱性:NaOH>Mg(OH)2>AI(OH)3 |
| D.氧化性:F2>C12>Br2 |
元素的性质呈周期性变化的根本原因是( )
| A.随着元素相对原子质量的递增,量变引起质变 |
| B.元素的原子半径呈周期性变化 |
| C.元素原子核外电子排布呈周期性变化 |
| D.元素的金属性和非金属性呈周期性变化 |
下列关于第IVA族元素的说法中,正确的是
| A.原子半径:14Si>32Ge |
| B.稳定性:CH4<SiH4 |
| C.酸性:H2CO3>H2SiO3 |
| D.碱性:32Ge(OH)4>50Sn(OH)4>82Pb(OH)4 |
已知第三周期元素M,其原子最外层达到饱和时所需的电子数小于次外层与最内层电子数之差,且等于最内层电子数的正整数倍。下列关于元素M的说法一定错误的是
| A.M元素存在同素异形体 |
| B.M元素为非金属元素 |
| C.M的最高价氧化物对应的水化物都是强酸 |
| D.常温下,能稳定存在的M的氧化物都是酸性氧化物 |
如图是元素周期表的一部分,下列关系正确的是
| A.还原性:Se2->S2->Cl- |
| B.热稳定性:HCl>H2Se>HBr |
| C.原子半径:Se>Cl>S |
| D.酸性:HBrO4>HClO>H2SO4 |