题目内容
【题目】pH=3的HF和pH=11的NaOH溶液等体积混合后,溶液显________,溶液中的离子浓度大小关系是_________。
【答案】酸 c(F-)>c(Na+)>c(H+)>c(OH-)
【解析】
氢氟酸是弱酸,在溶液中存在电离平衡,根据与NaOH溶液混合后溶液中溶质成分判断溶液酸碱性,并比较离子浓度大小。
氢氟酸是弱酸,在溶液中存在电离平衡HF![]() H++F-,pH=3的HF溶液中,c(HF)>10-3 mol/L,pH=11的NaOH溶液中c(OH-)=10-3 mol/L,二者等体积混合后,电离的HF与NaOH恰好中和,溶液中还有过量的HF,溶液为HF与NaF的混合溶液,HF进一步电离产生H+、F-,使溶液显酸性,所以c(H+)>c(OH-),c(F-)>c(Na+),盐电离产生的离子浓度大于弱电解质电离产生的离子浓度,c(Na+)>c(H+),故溶液中离子浓度关系为:c(F-)>c(Na+)>c(H+)>c(OH-)。
H++F-,pH=3的HF溶液中,c(HF)>10-3 mol/L,pH=11的NaOH溶液中c(OH-)=10-3 mol/L,二者等体积混合后,电离的HF与NaOH恰好中和,溶液中还有过量的HF,溶液为HF与NaF的混合溶液,HF进一步电离产生H+、F-,使溶液显酸性,所以c(H+)>c(OH-),c(F-)>c(Na+),盐电离产生的离子浓度大于弱电解质电离产生的离子浓度,c(Na+)>c(H+),故溶液中离子浓度关系为:c(F-)>c(Na+)>c(H+)>c(OH-)。

 阅读快车系列答案
阅读快车系列答案【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
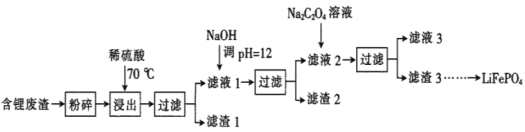
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
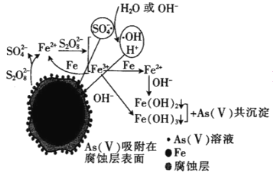
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。