题目内容
16. (1)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(1)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)?Y(g)+Z(s)
(乙)A(s)+2B(g)?c(g)+D(g),
当下列物理量不再发生变化时:
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的总物质的量
其中能表明(甲)达到化学平衡状态是①②③④⑤,能表明(乙)达到化学平衡状态是②③.
(2)一定温度下,在2L的恒容密闭容器中,X,Y,Z三种气体的物质的量随时间变化的曲线如图所示:从反应开始到10s时,用Z表示的反应速率为0.079mol/(L•s),X的物质的量浓度减少了0.395mol/L,Y的转化率为79%.
分析 (1)甲反应是气体体积减小的反应,乙是气体体积不变的反应,判断反应达到平衡状态的标志是正逆反应速率相同,各组分含量保持不变,及其衍生的物理量分析判断;注意乙反应是一个反应前后气体体积不变的化学反应,所以不能用压强判断平衡;
(2)根据化学反应中各物质的物质的量变化量,图象变化分析根据v=$\frac{△c}{△t}$计算化学反应速率;根据平衡图象计算物质的量浓度及转化率.
解答 解:(1)①混合气体密度不变,甲反应是气体体积减小的反应,甲容器中气体体积不变,质量会变,密度也变,能判断达到平衡,由于乙反应的两边气体的体积相同且都是气体,容器的容积不变,所以密度始终不变,无法判断乙是否达到平衡状态;
②反应容器中生成物的百分含量不变是平衡标志;
③反应物的消耗速率与生成物的消耗速率之比等于系数之比,说明正逆反应速率相同,反应甲、乙达到平衡状态;
④恒温时,气体压强不再改变,乙反应的两边气体的体积相同且都是气体,压强始终不变,所以压强不变无法判断乙是否达到平衡状态,可以判断甲达到平衡状态;
⑤甲反应是气体体积减小的反应,乙是气体体积不变的反应,混合气体的总物质的量不变说明甲达到平衡状态,乙不能判断是否达到平衡状态;
故答案为:①②③④⑤;②③;
(2)反应开始到10s,用Z表示的反应速率为:v=$\frac{△c}{△t}$=$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),
反应开始到10s,X的物质的量浓度减少的量为:△c=$\frac{1.20mol-0.41mol}{2L}$=0.395mol/L,反应开始到10s时,Y的转化率为$\frac{1.0mol-0.21mol}{1.0mol}$×100%=79%,
故答案为:0.079mol/(L•s);0.395mol/L;79%.
点评 本题考查了化学平衡状态的判断,物质的量随时间的变化曲线,以及化学平衡的计算,难度不大,注意反应前后气体体积不变的化学反应不能用压强来判断是否达到平衡状态.

| A. | 该反应属于置换反应 | B. | 该反应的还原剂是NH3 | ||
| C. | Cl2的氧化性小于N2 | D. | 被氧化的NH3占参加反应NH3的1/4 |
| A. | Na+Fe3+ Cl-NO3- (1:1:3:1) | |
| B. | Ca2+ K+ OH- HCO3- (1:1:2:1) | |
| C. | H+ SO42- OH- Ba2+ (2:1:2:1) | |
| D. | Na+ PO43- H+ SO42- (2:1:3:1) |
| A. | 过氧化钠的电子式: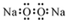 | B. | 中子数为 20 的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 硫离子的结构示意图: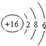 | D. | HCN的结构式:H-C≡N |
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>Na2O>N2>O2 | D. | 金刚石>生铁>纯铁>钠 |
| 实验编号 | 实验步骤 | 实验现象 |
| ② | 加入AgNO3溶液 | 有沉淀产生 |
| ③ | 加入足量NaOH溶液后加热 | 收集气体0.896L(标准状况) |
| ④ | 加入足量的BaCl2 溶液 | 得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g |
| A. | c(K+)≥0.2 mol/L | |
| B. | 一定存在的离子:Cl-、NH4+、CO32-、SO42- | |
| C. | 一定不存在的离子:Ca2+、K+、Cl- | |
| D. | c(K+)+c(NH4+)=c(CO32-)+c(SO42-) |
| A. | Na2SO4 | B. | NaOH | C. | HNO3 | D. | FeO |