题目内容
【题目】下列说法中错误的是
A. 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B. 1 mol金刚石晶体中,平均含有2 mol C—C键
C. 水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
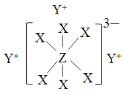
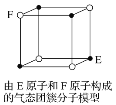
D. 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
【答案】D
【解析】
A.PH4+、PO43-中都形成4个σ键,且孤电子对数分别为0,则应为正四面体结构,选项A正确;
B.金刚石晶体中,每个C原子与其它4个C原子形成共价键,且每2个C原子形成1个共价键,则1 mol金刚石晶体中,平均含有4mol×![]() =2 molC-C键,选项B正确;
=2 molC-C键,选项B正确;
C.氢键的作用力大于分子间作用力,H2O分子间存在氢键,H2S分子间不能形成氢键,导致水的沸点比硫化氢的高,选项C正确;
D.团簇分子中含有4个E、4个F原子,分子式应为E4F4或F4E4,选项D错误。
答案选D。

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目