题目内容
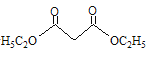
【题目】清代化学家徐寿创立了化学元素的中文名称和造字原则,推动了化学知识在中国的传播和应用。物质A由原子序数依次增大的短周期元素X、Y、Z组成,其中Z为金属元素,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如图所示:

回答下列问题:
(1)Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是__________。
(2)比较X、Y、Z简单离子的半径大小(用对应离子符号表示)__________。
(3)在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式__________。
(4)与X同主族的元素溴和碘可以发生下列置换反应:Br2+2I-=2Br-+I2,I2+2BrO3-=2IO3-+Br2,这两个置换反应矛盾吗?简述理由__________。
【答案】第三周期第ⅠA族 F>Na+>Al3+ NaAlO2+6NaF+4CO2+2H2O=Na3AlF6+4NaHCO3 不矛盾。前者Br2是氧化剂,I2是氧化产物,氧化剂的氧化性大于氧化产物;后者I2是还原剂,Br2是还原产物,还原剂的还原性大于还原产物。(不矛盾;前者是“Br”得电子倾向强于“I”,后者是“I”失电子倾向强于“Br”)
【解析】
分析A的结构式,其中Y形成+1价的阳离子,X可形成一个共价键,Z成六个共价键,X、Y、Z为原子序数依次增大的短周期元素,其中Z为金属元素。由此可推断X形成-1价的阴离子,可推测X为F元素,根据X和Z形成显-3价的阴离子,可知Z应显+3价,且Z为金属元素,则Z为Al元素。由X、Y、Z简单离子的核外电子排布相同,可知Y为Na元素,据此进行分析。
(1)Na元素在元素周期表中位于第三周期第ⅠA族,答案为:第三周期第ⅠA族;
(2)根据核外电子排布相同时,核电荷数越大,离子半径越小,X、Y、Z简单离子的核外电子排布相同,则其离子半径大小关系为:F>Na+>Al3+;答案为:F>Na+>Al3+;
(3)根据题意及原子守恒,可知化学反应方程式为:NaAlO2+6NaF+4CO2+2H2O=Na3AlF6+4NaHCO3;答案为:NaAlO2+6NaF+4CO2+2H2O=Na3AlF6+4NaHCO3;
(4)不矛盾;分析两个反应,在前一个反应中,Br2作为氧化剂,将I-氧化为I2,I2为氧化产物,体现了氧化性:Br2>I2;在后一个反应中,BrO3-中Br的化合价降低,被还原为Br2,Br2为还原产物,I2作为还原剂,体现了还原性:I2>Br2。答案为:不矛盾;前者Br2是氧化剂,I2是氧化产物,氧化剂的氧化性大于氧化产物;后者I2是还原剂,Br2是还原产物,还原剂的还原性大于还原产物。(不矛盾;前者是“Br”得电子倾向强于“I”,后者是“I”失电子倾向强于“Br”)。

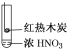
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应