题目内容
18.图中甲为甲醇燃料电池(电解质溶液为KOH溶液),该同学想在乙中实现铁上镀铜,则a处电极上发生的电极反应式是CH3OH+8OH--6e-=CO32-+6H2O.负极区的pH减小(填“增大”、“减小”、“不变”)某一电极的质量减轻 6.4g,则消耗的O2在标准状况下的体积为1.12L.
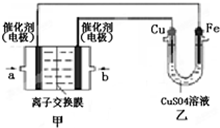
分析 在乙中实现铁上镀铜,则Cu作阳极、Fe作阴极,甲中左边a电极为负极、右边b电极为正极,燃料电池中,通入燃料的电极为负极、通入氧化剂的电极为正极,所以a处通入的气体是甲醇、b处通入的气体是氧气,a电极上电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,b电极上电极反应式为O2+4e-+2H2O=4OH-,根据串联电路中转移电子相等计算消耗O2体积.
解答 解:在乙中实现铁上镀铜,则Cu作阳极、Fe作阴极,甲中左边a电极为负极、右边b电极为正极,燃料电池中,通入燃料的电极为负极、通入氧化剂的电极为正极,所以a处通入的气体是甲醇、b处通入的气体是氧气,a电极上电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,所以负极区的pH减小,b电极上电极反应式为O2+4e-+2H2O=4OH-,当铜电极质量减去6.4g时,失去电子的物质的量=$\frac{6.4}{64}$×2=0.2mol,串联电路中转移电子相等,所以消耗的O2在标准状况下的体积为=$\frac{0.2}{4}$×22.4=1.12L,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;减小;1.12L.
点评 本题考查了原电池和电解池原理,知道燃料电池中电极材料和其相应的电解质关系、串联电路中转移电子相等即可解答,难点是热量电池中电极反应式的书写,要结合电解质溶液酸碱性书写,为易错点.

练习册系列答案
相关题目
8.下列反应中不属于加成反应的是( )
| A. | CH2=CH2+H-OH$\frac{\underline{催化剂}}{△}$CH3-CH2-OH | |
| B. | CH2=CH-CH=CH2+2H2$\frac{\underline{\;催化剂\;}}{\;}$CH3-CH2-CH2-CH3 | |
| C. |  +H2$\stackrel{催化剂}{→}$CH3-CH2-OH +H2$\stackrel{催化剂}{→}$CH3-CH2-OH | |
| D. | CH3-CH3+2Cl2$\stackrel{光照}{→}$CH2Cl-CH2Cl+2HCl |
6.在常温下,将一定体积的某 NaOH 溶液分成两等分,与pH均为2的一元酸 HA、HB恰好中和,消耗两种酸溶液的体积分别为V1、V2(V1≠V2).则下列叙述中正确的是( )
| A. | 若 Vl>V2,则说明HA的酸性比 HB的酸性强 | |
| B. | 中和后得到的两种溶液的pH均为 7 | |
| C. | 分别将两种酸溶液稀释10 倍后溶液的pH均为3 | |
| D. | 分别往等体积的两种酸溶液中加人足量锌粉,充分反应后产生的H2的体积相等 |
13.下列叙述中,金属A的活泼性肯定比金属B的活泼性强的是( )
| A. | A原子的主族序数比B原子的主族序数大 | |
| B. | A原子的周期序数B原子的周期序数大 | |
| C. | 1mol A 与酸反应置换出的H2比1 mol B与酸反应置换出的H2多 | |
| D. | 把AB用导线连接后放入盛有稀硫酸的烧杯中,B上产生气泡 |
10.将浓硫酸和稀硫酸在实验室中分别敞口放置.它们的质量和放置天数的关系如图,分析a、b曲线变化的原因是( )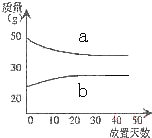

| A. | a挥发、b吸水 | B. | a升华、b冷凝 | C. | a蒸发、b潮解 | D. | a冷凝、b吸水 |
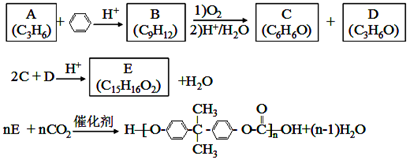
 ;D有多种同分异构体,其中含有醛基的是CH3CH2CHO.按官能团分类E为酚.
;D有多种同分异构体,其中含有醛基的是CH3CH2CHO.按官能团分类E为酚.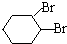 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$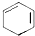 +2NaBr+2H2O.
+2NaBr+2H2O.