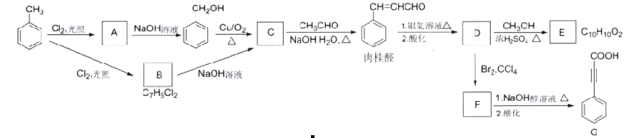
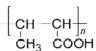
题目内容
【题目】随着石油资源的日益枯竭,天然气的廾发利用越来越受到重视。CH4/CO2催化重整制备合成气(CO和H2)是温室气体CO2和CH4资源化利用的重要途径之一,并受了国内外研究人员的高度重视。回答下列问题:
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CH4/CO2催化重整反应为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
该催化重整反应的△H=______kJ·mol-1。要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为_____。
(2)向2L刚性密闭容器中充入2molCH4和2mol CO2进行催化重整反应,不同温度下平衡体系中CH4和CO的体积分数(![]() )随温度变化如下表所示。
)随温度变化如下表所示。
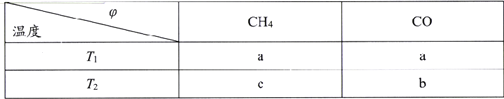
已知b>a>c,则T1______T2(填“>”“<”或“=”)。T1下该反应的平衡常数K=_______(mol2·L-2)
(3)实验硏究表明,载体对催化剂性能起着极为重要的作用,在压强0.03MPa,温度750℃条件下,载体对镍基催化剂性能的影响相关数据如下表:

由上表判断,应选择载体为_______(填化学式),理由是________。
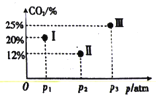
(4)现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均充入2mol CH4(g)和2 molCO2(g)进行反应,三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的情况下,反应均进行到tmin时,CO2的体积分数如图所示,此时I、Ⅱ、Ⅲ个容器中一定处于化学平衡状态的是_______。
(5)利用合成气为原料合成甲醇,其反应为CO(g)+2H2(g)![]() CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
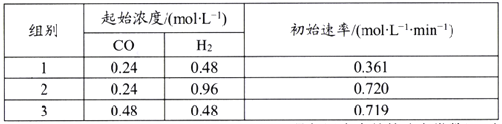
该反应速率的通式为ν正=k正cm(CO)·cn(H2)(k正是与温度有关的速率常数)。由表中数据可确定反应速率的通式中n=____(取正整数)。若该温度下平衡时组别1的产率为25%,则组别1平衡时的v正=______(保留1位小数)。
【答案】+247.1 升高温度 < ![]() MgO 此条件下合成气产率高 III 1 0.2mol/(L·min)
MgO 此条件下合成气产率高 III 1 0.2mol/(L·min)
【解析】
(1)依据盖斯定律作答;
(2)CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)反应吸热,依据外因对化学反应速率与化学平衡的综合影响来分析;结合表格数据,依据升高温度对物质体积分数的影响效果判断温度高低,再利用甲烷与CO的平衡体积分数相等计算出转化的甲烷的物质的量,列出三段式,根据平衡常数的表达式计算解答;
2CO(g)+2H2(g)反应吸热,依据外因对化学反应速率与化学平衡的综合影响来分析;结合表格数据,依据升高温度对物质体积分数的影响效果判断温度高低,再利用甲烷与CO的平衡体积分数相等计算出转化的甲烷的物质的量,列出三段式,根据平衡常数的表达式计算解答;
(3)依据表格数据,选择合成CO和氢气量最多的物质作为载体;
(4)根据温度和压强对平衡的影响,结合平衡状态的特征回答;
(5)结合表格中三组数值,列出三个方程,解方程组即可求出n的值;再列出三段式,分别求出c(CO)与c(H2)的值,带入通式求得v正。
(1)①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
①-②可得到CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),则根据盖斯定律可知△H=+205.9 kJ·mol-1-(-41.2 kJ·mol-1)= +247.1 kJ·mol-1,因此该反应为吸热反应,要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为升高温度,
2CO(g)+2H2(g),则根据盖斯定律可知△H=+205.9 kJ·mol-1-(-41.2 kJ·mol-1)= +247.1 kJ·mol-1,因此该反应为吸热反应,要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为升高温度,
故答案为:+247.1;升高温度;
(2)同一个物质在不同的温度下所占的体积分数不同,因CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.1 kJ·mol-1,该反应为吸热反应,则升高温度则有利用平衡向正反应方向移动,导致CH4的体积分数降低,CO的体积分数升高。已知b>a>c,根据图表信息可知,T1<T2;T1下该反应的CH4与CO的体积分数均为a,则设CH4转化浓度为x mol/L,
2CO(g)+2H2(g) △H=+247.1 kJ·mol-1,该反应为吸热反应,则升高温度则有利用平衡向正反应方向移动,导致CH4的体积分数降低,CO的体积分数升高。已知b>a>c,根据图表信息可知,T1<T2;T1下该反应的CH4与CO的体积分数均为a,则设CH4转化浓度为x mol/L,

则根据T1下该反应的CH4与CO的体积分数均为a易知,![]() ,解得x=
,解得x=![]() ,所以平衡常数
,所以平衡常数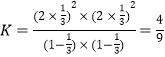 ,
,
故答案为:<;![]() ;
;
(3)从表中可以看出,MgO的原料转化率较高,且合成气的产率较高,所以选择MgO作为载体,
故答案为:MgO;此条件下合成气产率高;
(4)由于不能确定容器Ⅱ中二氧化碳的体积分数是否达到最小值,因此不能确定Ⅱ是否达到平衡状态,若未达平衡,压强越高反应逆向移动,相同时间内二氧化碳的含量越高,p3时,二氧化碳Ⅲ的含量比Ⅱ高,故Ⅲ到达平衡,
故答案为:III;
(5)组别1中c(CO)=0.24mol/L,c(H2) =0.48 mol/L,初始速率v正=0.361 mol/(L·min);则依据ν正=k正cm(CO)·cn(H2)可知,①0.361 mol/(L·min)=k正×(0.24 mol/L)m×(0.48 mol/L)n;同理,根据表格数据可得②0.720 mol/(L·min)=k正×(0.24 mol/L)m×(0.96 mol/L)n;③0.719 mol/(L·min)=k正×(0.48 mol/L)m×(0.48 mol/L)n;则②/①可得2=2n,即n=1;③/①得2=2m,则m=1;带入①得k正=3.134 L /min·mol。若该温度下平衡CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),组别1的产率为25%,设转化的CH4的物质的量浓度为y mol/L,则
2CO(g)+2H2(g),组别1的产率为25%,设转化的CH4的物质的量浓度为y mol/L,则

则![]() ,则y=0.12,则c(CO)=2y=0.24mol/L,c(H2) =2y=0.24 mol/L,k正是与温度有关的速率常数,保持不变,则依据给定公式可得ν正=k正c(CO)·c(H2)= 3.134 L /min·mol×0.24mol/L×0.24mol/L=0.180
,则y=0.12,则c(CO)=2y=0.24mol/L,c(H2) =2y=0.24 mol/L,k正是与温度有关的速率常数,保持不变,则依据给定公式可得ν正=k正c(CO)·c(H2)= 3.134 L /min·mol×0.24mol/L×0.24mol/L=0.180![]() 0.2 mol/(L·min),
0.2 mol/(L·min),
故答案为:1;0.2mol/(L·min)。

 阅读快车系列答案
阅读快车系列答案