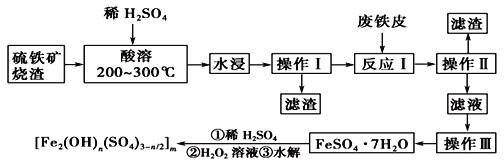
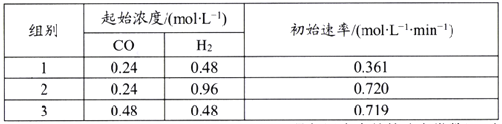
题目内容
【题目】某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

(1)该温度下水的离子积为______。
(2)该温度下0.01 mol/L NaOH溶液的pH为____。
(3)该温度下,将pH=12的NaOH溶液Va L与pH=2的H2SO4溶液Vb L混合,混合溶液呈中性,则Va﹕Vb=_______
【答案】1×10-15mol2L-2 13 10﹕1
【解析】
(1)离子积常数Kw=c(H+)·c(OH-);
(2)根据该温度下水的离子积常数计算NaOH溶液的pH;
(3)混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,据此计算Va﹕Vb。
(1)根据图知,当c(H+)=1×10-5mol/L,c(OH-)=1×10-10mol/L,由离子积常数Kw=c(H+)·c(OH-)=1×10-5mol/L×1×10-10mol/L=1×10-15mol2L-2,故答案为:1×10-15mol2L-2。
(2)该温度下,氢氧化钠溶液中氢离子浓度=1×10-15mol2L-2÷0.01mol/L=10-13mol/L,pH=13,故答案为:13。
(3)pH=12的NaOH溶液中c(H+)=10-12mol/L
则氢氧化钠溶液中c(OH-)=Kw/c(H+)=10-15(mol/L)2/10-12mol/L=10-3mol/L
pH=2的硫酸中c(H+)=10-2mol/L,
若所得混合液为中性,则c(H+)×Vb=c(OH-)×Va,
Va:Vb=10-2:10-3=10:1。
故答案为:10﹕1。

练习册系列答案
相关题目