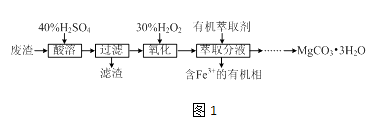
��Ŀ����
����Ŀ��T��ʱ����2L�����ܱ���������̬����X��Y��Z�����ʵ�����ʱ��仯�IJ������������ʾ��
T/min | n��X��/mol | n��Y��/mol | n��Z��/mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
��1��д���÷�Ӧ�Ļ�ѧ����ʽ
��2����Ӧ���е�10min��X��ת����Ϊ �� 0��5min��Y��ƽ����Ӧ����Ϊ
��3������T��ʱ�÷�Ӧ��ƽ�ⳣ��K=
��4��T��������ܱ�������ͨ��һ������X��Y��Z����Ӧ��ijʱ�̲��X��Y��Z�����ʵ����ֱ�Ϊ1.00mol��0.50mol��1.60mol�����ʱ���淴Ӧ���ʴ�С��v��v��������ڡ��������ڡ�����С�ڡ���
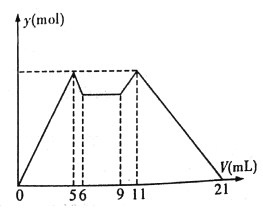
��5������10min��t3��t5ʱ�̷ֱ�ı�÷�Ӧ��ijһ��Ӧ�������õ�X��Z�����ʵ�������Ӧ������ʱ��Ĺ�ϵ��ͼA��B��ʾ�� 
��10minʱ�ı�ķ�Ӧ������
��t3ʱ�̸ı�ķ�Ӧ������t5ʱ�̸ı�ķ�Ӧ������ �� ������ ��
���𰸡�
��1��X+2Y?2Z
��2��50%��0.07mol/��L?min��
��3��80L/mol
��4������
��5������Y��Ũ�ȣ������¶ȣ��Ӵ�����t5ʱ�����淴Ӧ����ͬ�ȳ̶����������
���������⣺��1���ɱ������ݿ�֪��X��YΪ��Ӧ�ZΪ�����1minʱ��n��X��=0.8mol��0.7mol=0.1mol����n��Y��=1mol��0.8mol=0.2mol����n��X������n��Y��=1��2��10min������ʵ����ʵ������ٱ仯����Ӧ�ﲻΪ0����Ϊ���淴Ӧ����ʱ��n��X��=0.8mol��0.4mol=0.4mol�����n��Y��=0.8mol����n��Z��=0.8mol���ٸ������ʵ����仯��֮�ȵ��ڻ�ѧ������֮�ȣ���n��X����n��Y����n��Z��=0.4mol��0.8mol��0.8mol=1��2��2����Ӧ����ʽΪX+2Y2Z�����Դ��ǣ���Ӧ����ʽΪX+2Y2Z����2���ɱ������ݿ�֪��10minʱ����n��X��=0.8mol��0.4mol=0.4mol����X��ת����Ϊ�� ![]() =50%����ӦX+2Y2Z��0��5min�ڣ�Z�ķ�Ӧ����Ϊ��
=50%����ӦX+2Y2Z��0��5min�ڣ�Z�ķ�Ӧ����Ϊ�� ![]() =0.07mol/��Lmin������Ӧ����֮��=��ѧ������֮�ȣ���Y�ķ�Ӧ����Ϊ��0.07mol/��Lmin�������Դ��ǣ�50%�� 0.07mol/��Lmin����
=0.07mol/��Lmin������Ӧ����֮��=��ѧ������֮�ȣ���Y�ķ�Ӧ����Ϊ��0.07mol/��Lmin�������Դ��ǣ�50%�� 0.07mol/��Lmin����
3���������ݣ���
X+ | 2Y | 2Z | ||
��ʼ���� | 0.8 | 1 | 0 | |
ת������ | 0.4 | 0.8 | 0.8 | |
ƽ������ | 0.4 | 0.2 | 0.8 |
��k= ![]() =80 L/mol�����Դ��ǣ�80 L/mol����4���¶Ȳ��䣬k���䣬X��Y��Z�����ʵ����ֱ�Ϊ1.00mol��0.50mol��1.60mol����ʱQc=
=80 L/mol�����Դ��ǣ�80 L/mol����4���¶Ȳ��䣬k���䣬X��Y��Z�����ʵ����ֱ�Ϊ1.00mol��0.50mol��1.60mol����ʱQc= ![]() ��80����Ӧ������������У���v����v�������Դ��ǣ����ڣ���5���ٷ���ͼ��A��10minʱ��X���٣�Z���࣬ͼ��B��Ӧ�����������ƶ���Ϊ����Y��Ũ�ȣ����Դ��ǣ�����Y��Ũ�ȣ� ��t3��Ӧ��������Ӧ�����ƶ�����Ӧ���ʾ�������Ӧ���ǽ����¶ȣ�t5ʱ��Ӧ���ʼӿ죬��ƽ�ⲻ�ƶ���������Ӱ��ƽ�⣬��Ϊ�Ӵ��������Դ��ǣ����»��¶ȣ�ʹ�ô��� ���ô�����Ӵ�����t5ʱ�����淴Ӧ����ͬ�ȳ̶���������ȣ�
��80����Ӧ������������У���v����v�������Դ��ǣ����ڣ���5���ٷ���ͼ��A��10minʱ��X���٣�Z���࣬ͼ��B��Ӧ�����������ƶ���Ϊ����Y��Ũ�ȣ����Դ��ǣ�����Y��Ũ�ȣ� ��t3��Ӧ��������Ӧ�����ƶ�����Ӧ���ʾ�������Ӧ���ǽ����¶ȣ�t5ʱ��Ӧ���ʼӿ죬��ƽ�ⲻ�ƶ���������Ӱ��ƽ�⣬��Ϊ�Ӵ��������Դ��ǣ����»��¶ȣ�ʹ�ô��� ���ô�����Ӵ�����t5ʱ�����淴Ӧ����ͬ�ȳ̶���������ȣ�
�����㾫����������Ҫ�����˻�ѧƽ��ļ�������֪ʶ�㣬��Ҫ���շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%������ȷ�����⣮

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�