题目内容
【题目】在m毫升b摩/升AlCl3溶液中加入等体积a摩/升NaOH溶液。
(1)当0<a≤3b时,生成Al(OH)3沉淀的物质的量是_______________。
(2)当 a=3b时, 生成沉淀 _______ 克
(3)当a,b满足___________条件时,无沉淀生成。
(4)当3b≤a<4b时,有沉淀生成,生成Al(OH)3沉淀的质量是__________
【答案】 ![]() 0.026 am 或0.078 bm a≥4b
0.026 am 或0.078 bm a≥4b ![]()
【解析】试题分析:(1)AlCl3和NaOH反应,3NaOH+AlCl3=Al(OH)3+3NaCl,当a≤3b时,反应中NaOH不足量,以NaOH为标准进行计算,
设生成Al(OH)3沉淀的物质的量为x mol。
3:1= m×10-3×a:x
解得 x= am/3000mol,
(2)当 a=3b时, AlCl3和NaOH的物质的量之比为1:3,二者恰好完全反应,
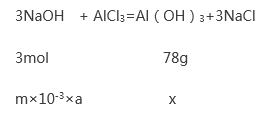
3:78= m×10-3×a:x
解得 x= 78am/3000g=0.026 am g
或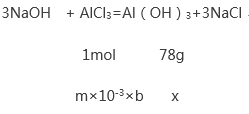
1:78= m×10-3×b:x
解得 x= 78bm/1000g=0.078 bm g
(3)AlCl3和NaOH反应生成Al(OH)3,Al(OH)3是两性氢氧化物,能够溶于过量的NaOH溶液,NaOH+Al(OH)3=NaAlO2+2H2O,
总方程式为4NaOH+AlCl=NaAlO2+3NaCl+2H2O,由方程式可得,

a:b=4:1
所以a=4b或a>4b;即a≥4b时没有沉淀。
(3)3b≤a<4b时,先有沉淀生成后又有部分沉淀溶解,铝离子部分以氢氧化铝沉淀的形式存在,部分以偏铝酸根离子的形式存在;设AlCl3转化为Al(OH)3的物质的量是xmol,则生成NaAlO2的AlCl3为(m×10-3b-x)mol,根据3NaOH+AlCl3=Al(OH)3+3NaCl,生成氢氧化铝沉淀消耗氢氧化钠3xmol,根据4NaOH+AlCl=NaAlO2+3NaCl+2H2O,生成偏铝酸钠消耗氢氧化钠4(m×10-3b-x)mol,3xmol+4(m×10-3b-x)mol= m×10-3×a,x= ![]() mol,所以氢氧化铝的质量是
mol,所以氢氧化铝的质量是![]() 。
。

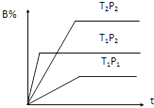
【题目】T℃时,在2L恒容密闭容器中气态物质X、Y、Z的物质的量随时间变化的部分数据如表所示:
T/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
(1)写出该反应的化学方程式
(2)反应进行到10min,X的转化率为 , 0~5min内Y的平均反应速率为
(3)计算T℃时该反应的平衡常数K=
(4)T℃下向该密闭容器中通入一定量的X、Y、Z,反应到某时刻测得X、Y、Z的物质的量分别为1.00mol、0.50mol、1.60mol,则此时正逆反应速率大小:v正v逆(填“大于”、“等于”、“小于”)
(5)若在10min和t3、t5时刻分别改变该反应的某一反应条件,得到X、Z的物质的量及反应速率与时间的关系如图A、B所示: 
①10min时改变的反应条件是
②t3时刻改变的反应条件是t5时刻改变的反应条件是 , 理由是 .