��Ŀ����
����Ŀ������������ȷ���ǣ� �� 
A.Cu2O��һ�ְ뵼����ϣ�������ɫ��ѧ������Ƶ���ȡCu2O�ĵ���ʾ��ͼ��ͼһ��ʾ��ʯī�缫�ϲ���������ͭ�缫����������Ӧ
B.ͼһ��ʾ����0.1mol����ת��ʱ����0.1mol Cu2O����
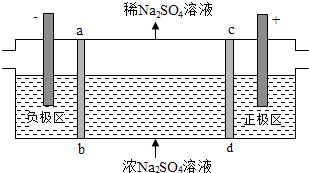
C.ͼ��װ���з�����Cu+2Fe3+�TCu2++2Fe2+ �� X���Ǹ�����Y�����Ͽ�����ͭ
D.��ͼ�������ŵ������Ǵ��ݵ����ά�ֵ��ƽ�⣬Fe3+�������Ž�������ձ���
���𰸡�A
���������⣺A�����ݵ���ܷ�ӦΪ2Cu+H2O�TCu2O+H2������֪������ͭΪ�������ϣ�Cuʧ���ӷ���������Ӧ��ʯīΪ�������ϣ������������ӵõ���������������A��ȷ��B��2molCuʧȥ2mol��������1molCu2O�����Ե���0.1mol����ת��ʱ����0.05mol Cu2O���ɣ���B����
C����֪Cu+2Fe3+�TCu2++2Fe2+ �� ���ԭ�����Cuʧ������������Cu������ͭ��Һ�У���XΪCu����YΪ�����Ա�ͭ���Ľ�����ķǽ���������������C����
D��ԭ������������������ƶ������ŵ������Ǵ��ݵ����ά�ֵ��ƽ�⣬�Ҳ�Ϊ����������Fe3+���Ҳ��ձ��в������ƶ�����D����
��ѡA��

����Ŀ��T��ʱ����2L�����ܱ���������̬����X��Y��Z�����ʵ�����ʱ��仯�IJ������������ʾ��
T/min | n��X��/mol | n��Y��/mol | n��Z��/mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
��1��д���÷�Ӧ�Ļ�ѧ����ʽ
��2����Ӧ���е�10min��X��ת����Ϊ �� 0��5min��Y��ƽ����Ӧ����Ϊ
��3������T��ʱ�÷�Ӧ��ƽ�ⳣ��K=
��4��T��������ܱ�������ͨ��һ������X��Y��Z����Ӧ��ijʱ�̲��X��Y��Z�����ʵ����ֱ�Ϊ1.00mol��0.50mol��1.60mol�����ʱ���淴Ӧ���ʴ�С��v��v��������ڡ��������ڡ�����С�ڡ���
��5������10min��t3��t5ʱ�̷ֱ�ı�÷�Ӧ��ijһ��Ӧ�������õ�X��Z�����ʵ�������Ӧ������ʱ��Ĺ�ϵ��ͼA��B��ʾ�� 
��10minʱ�ı�ķ�Ӧ������
��t3ʱ�̸ı�ķ�Ӧ������t5ʱ�̸ı�ķ�Ӧ������ �� ������ ��