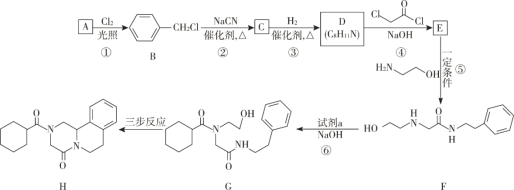
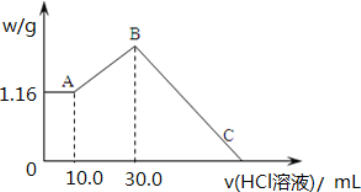
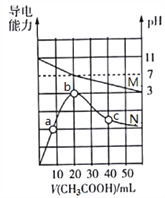
题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A.25 ℃,pH=12的Na2CO3溶液中含有OH-的数目为0.01NA
B.1 mol苯乙烯(![]() )中含有的碳碳双键数为4NA
)中含有的碳碳双键数为4NA
C.加热条件下,4.6 g金属Na与足量O2反应的产物中阳离子和阴离子总数为0.3NA
D.常温时,1 L 0.1 mol·L-1的硝酸铵溶液中,NH4+和H+总数为0.1NA
【答案】C
【解析】
A、25 ℃,pH=12的Na2CO3溶液中含有OH-的浓度是0.01mol/L,但不能确定溶液的体积,则不能计算其数目,A错误;
B、苯环不含有碳碳双键,则1 mol苯乙烯中含有的碳碳双键数为NA,B错误;
C、不论是氧化钠还是过氧化钠,阴阳离子的个数之比均是1:2,所以加热条件下,4.6 g金属Na即0.2molNa与足量O2反应的产物中阳离子和阴离子总数为0.3NA,C正确;
D、根据电荷守恒可知c(NH4+)+ c(H+)= c(NO3-)+ c(OH-),常温时,1 L 0.1 mol·L-1的硝酸铵溶液中,NO3-的物质的量为0.1mol,则NH4+和H+总数大于0.1NA,D错误。
答案选C。

【题目】现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为 。