题目内容
18.有机物中碳原子和氢原子个数比为3:4,不能与溴水反应却能使KMnO4酸性溶液褪色.其蒸气密度是相同状况下甲烷密度的7.5倍.在溴化铁存在时与溴反应,能生成两种一溴代物.该有机物可能是( )| A. | CH≡C-CH3 | B. | 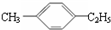 | C. | CH2=CHCH3 | D. | 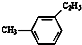 |
分析 有机物中碳原子和氢原子个数比为3:4,不能与溴水反应却能使KMnO4酸性溶液褪色,说明该物质中不含碳碳不饱和键或醛基,可能为苯的同系物且连接苯环的碳原子上含有氢原子;
其蒸气密度是相同状况下甲烷密度的7.5倍,则该物质的相对分子质量=16×7.5=120;
在溴化铁存在时与溴反应,能生成两种一溴代物,说明苯环上含有两种氢原子,据此分析解答.
解答 解:有机物中碳原子和氢原子个数比为3:4,不能与溴水反应却能使KMnO4酸性溶液褪色,说明该物质中不含碳碳不饱和键或醛基,可能为苯的同系物且连接苯环的碳原子上含有氢原子;
其蒸气密度是相同状况下甲烷密度的7.5倍,则该物质的相对分子质量=16×7.5=120;
在溴化铁存在时与溴反应,能生成两种一溴代物,说明苯环上含有两种氢原子,
A.该物质能和溴发生加成反应而使溴水褪色,故A错误;
B.该物质相对分子质量是120,苯环上含有两类氢原子,所以其苯环上一溴代物有两种;能被酸性高锰酸钾溶液氧化但不能和溴发生加成反应,故B正确;
C.该物质中含有碳碳双键,能和溴发生加成反应且相对分子质量不是120,故C错误;
D.该物质苯环上含有3类氢原子,所以其苯环上一溴代物有3种,故D错误;
故选B.
点评 本题考查有机物结构和性质,侧重考查分析解答能力,明确官能团及其性质关系是解本题关键,注意:只有连接苯环碳原子上含有氢原子的苯的同系物才能被酸性高锰酸钾溶液氧化,为易错点.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
1.下列反应的离子方程式正确的是( )
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氧化铝溶于氢氧化钠:Al2O3+2OH-═2AlO2-+H2↑ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 澄清石灰水中通入过量的二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
2.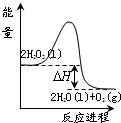 过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )
过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )
 过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )
过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )| A. | 该分解反应为吸热反应 | |
| B. | 2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量 | |
| C. | 加入MnO2或FeCl3均可提高该分解反应的速率 | |
| D. | 其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢 |
6.分子式为C5H10O2的羧酸共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 种 |
13.等体积pH=1的两种酸溶液A和B,分别加水稀释1000倍后,其pH分别为5和3,下列判断一定正确的是( )
| A. | 加入Mg粉,生成H2的体积:V(A)<V(B) | |
| B. | A为弱酸,B为强酸 | |
| C. | 加入Mg粉,生成H2的平均反应速率v(A)<v(B) | |
| D. | A溶液比B溶液导电性强 |
3.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | SO2和Si | B. | CO2和CH4 | C. | CsCl和H2SO4 | D. | CCl4和KCl |
10.25°C和101kpa时,甲烷、乙烯和乙炔组成的混合烃30mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了55mL,原混合烃中乙炔的体积分数为( )
| A. | 25% | B. | 33.3% | C. | 66.7% | D. | 75% |
 与葡萄糖
与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物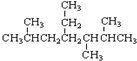 的名称为2,5,6-三甲基-4-乙基庚烷.
的名称为2,5,6-三甲基-4-乙基庚烷.