题目内容
【题目】(1)在标准状况下,0.5mol N2和1mol O2 的混合气体的体积约是_____.
(2)标准状况下,气体的摩尔体积是______,0.5mol CO2 的质量是____,在标准状况下的体积是_____.
(3)①标准状况下,2mol NH3与 _______g CO2的体积相等.
②等质量的O2和O3所含的原子个数之比是______.
③用金属Na、Mg、Al与足量的稀盐酸反应,欲制取相同条件下等体积的H2,则需要金属Na、Mg、Al的质量比为_____(最简整数比).
④已知14g A和40g B恰好完全反应生成0.25mol C和38g D,则C的相对分子质量为__.
【答案】33.6L 22.4L/mol 22g 11.2L 88 1:1 23:12:9 64
【解析】
根据n=m/M=V/Vm=N/NA进行计算,标况下,Vm为22.4L/mol。
(1)在标准状况下,N2和O2不反应,混合气体的总物质的量为1.5mol,则标况下的体积=1.5mol![]() 22.4L/mol=33.6L;
22.4L/mol=33.6L;
(2)标准状况下,气体的摩尔体积是22.4L/mol;m(CO2)=n![]() M=0.5mol
M=0.5mol![]() 44g/mol=22g;标况下的体积0.5mol
44g/mol=22g;标况下的体积0.5mol![]() 22.4L/mol=11.2L;
22.4L/mol=11.2L;
(3)①标准状况下,体积之比等于物质的量之比,NH3的体积与CO2的体积相等,则物质的量也相等,m(CO2)=2mol![]() 44g/mol=88g;
44g/mol=88g;
②等质量(m)的O2和O3所含的原子个数之比=![]() ×2:
×2:![]() ×3=1∶1;
×3=1∶1;
③金属与足量盐酸反应的方程式为2Na+2H+=2Na++H2↑、Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑,根据方程式若生成1mol氢气时,需要46gNa、24gMg、18gAl,则三种金属的质量之比为23∶12∶9;
④根据质量守恒定律,C的质量=14g+40g-38g=16g,M(C)=16g÷0.25mol=64g/mol。

 名校课堂系列答案
名校课堂系列答案【题目】某同学用某种粗盐进行提纯实验,步骤如图所示。
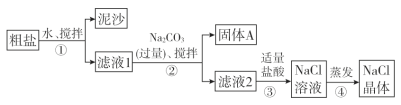
请回答下列问题:
(1)步骤①和②的操作名称是_______________。
(2)进行蒸发操作时,所需仪器除带铁圈的铁架台外,还需用到蒸发皿、________和________(不考虑顺序)。当蒸发皿中有较多量固体出现时,应________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含碳酸盐 | 取少量固体A于试管中,滴加稀盐酸,并用内壁涂有澄清石灰水的小烧杯罩住试管口 | ___________ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴加________,再滴加Na2SO4溶液 | 有气泡冒出,无白色沉淀 | 猜想II成立 |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体于试管中溶解,__________ | _________ | 猜想Ⅲ成立 |