题目内容
根据下图,下列判断中正确的是
| A.烧杯a中的溶液pH不变 |
| B.烧杯a中发生氧化反应 |
| C.烧杯a中发生的反应为2H2O+2e-=H2↑+2OH- |
| D.烧杯b中发生的反应为Zn-2e-=Zn2+ |
D
解析试题分析:A、根据装置图可知,该装置是原电池,金属性锌强于铁,所以锌是负极,失去电子,铁是正极,溶于水的氧气得到电子转变为OH-,所以烧杯a中的溶液pH增大,A不正确;B、烧杯a是正极,氧气得到电子发生还原反应,B不正确;C、正极是氧气得到电子,即烧杯a中发生的反应为O2+4e-+2H2O=4OH-,C不正确;D、锌是负极失去电子,则烧杯b中发生的反应为Zn-2e-=Zn2+,D正确,答案选D。
考点:考查原电池原理的应用与判断

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
下列说法中正确的是
| A.生成物总能量一定低于反应物总能量 |
B.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的 H不同 H不同 |
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) 2NH3(g)  H =-38.6 kJ/mol H =-38.6 kJ/mol |
| D.一定条件下4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ,当1 mol |
H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ

下列热化学方程式正确的是
| A.S(s)+O2(g)= SO2(g);ΔH= -269.8kJ/mol |
| B.NaOH (aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+57.3kJ/mol |
| C.表示乙醇的燃烧热:C2H5OH(l)+3O2(g)=2CO2(g)+ 3H2O(g);ΔH=-1367.0 kJ/mol |
| D.2NO2 = O2+2NO;ΔH= +116.2kJ/mol |
下列反应前后物质的总能量变化可用如图表示的是( )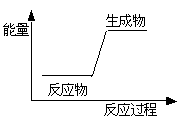
| A.生石灰加水生成熟石灰 |
| B.C+H2O=CO+H2 |
| C.金属钠与水反应 |
| D.HNO3+NaOH=NaNO3+H2O |
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程中正确的是
A.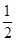 N2H4(g)+ N2H4(g)+ 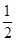 O2(g)= 1/2 N2(g)+ H2O(l)△H=+257kJ·mol-1 O2(g)= 1/2 N2(g)+ H2O(l)△H=+257kJ·mol-1 |
| B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ·mol-1 |
| C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ·mol-1 |
| D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ·mol-1 |
已知反应:①101kPa时,C(s)+ O2(g)═CO(g)△H1=-110.5kJ/mol
O2(g)═CO(g)△H1=-110.5kJ/mol
②稀溶液中:H+(aq)+ OH-(aq )═H2O(l) △H2=-57.3kJ/mol
下列说中正确的是
| A.若碳的燃烧热用△H3表示,则△H3<△H1 |
| B.若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C.浓硫酸与稀NaOH溶液反应的中和热值为57.3kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ的热量 |
已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g)= Fe3O4(s)+CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为
| A.-218 kJ/mol | B.-109 kJ/mol | C.+218 kJ/mol | D.+109 kJ/mol |
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
| A.该反应的正反应为放热反应 |
| B.升高温度,利于A的转化率增大 |
| C.加入催化剂时,该反应的反应热发生改变 |
| D.增大压强,能够加快反应达到平衡状态的速率 |
 CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。