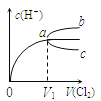
题目内容
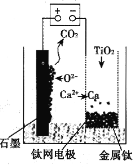
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
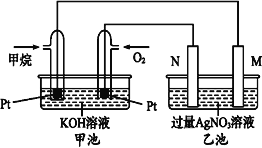
(1)M电极的材料是_____, 其电极反应式为:_______。N的电极名称是_____,其电极反应式为:_____。
(2)通入O2的铂电极的电极反应式为:________。
(3)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为_____L(标准状况下)。
【答案】石墨 2Ag++2e﹣═2Ag 阳极 Fe﹣2e﹣═Fe2+ O2+4e﹣+2H2O=4OH﹣ 0.224
【解析】
(1)碱性甲烷电池为原电池,通入甲烷的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,工作时N电极的质量减少,所以N是阳极铁电极,M是阴极,是石墨电极,根据燃料电池和电解池的工作原理回答;
(2)燃料电池的正极上是氧气发生得电子的还原反应;
(3)电解硝酸银溶液时,阴极反应式为Ag++e-=Ag,阳极反应式为4OH--4e-=O2↑+2H2O,结合电子的转移的物质的量的判断进行计算。
(1)由上述分析可知,M为阴极,电极材料为石墨;M极发生还原反应,其电极反应式为:2Ag++2e﹣═2Ag或Ag++e﹣═Ag;N电极为阳极,其电极反应式为:Fe﹣2e﹣═Fe2+,
故答案为:石墨;2Ag++2e﹣═2Ag或Ag++e﹣═Ag;阳极;Fe﹣2e﹣═Fe2+;
(2)氧气发生还原反应,电解质溶液为碱性,其电极反应式为:O2+4e﹣+2H2O=4OH﹣,
故答案为:O2+4e﹣+2H2O=4OH﹣;
(3)n(Ag)=![]() =0.04mol,根据Ag++e=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e=4H2O,则消耗n(O2)=
=0.04mol,根据Ag++e=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e=4H2O,则消耗n(O2)=![]() ×0.04mol=0.01mol,V(O2)=0.01mol×22.4L/mol=0.224L,
×0.04mol=0.01mol,V(O2)=0.01mol×22.4L/mol=0.224L,
故答案为:0.224。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案