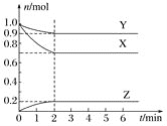
题目内容
【题目】金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料(主要为附在铝箔上的LiCoO2,还有少量铁的氧化物)中回收钴的一种工艺流程如图:

请回答下列问题:
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为__。
(2)溶液A中溶质除NaOH外,还有__。
(3)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有__(任写一条)。
②工业生产中一般不用盐酸浸取“钴渣”,其原因是__。
③“钴渣”中LiCoO2溶解时的离子方程式为__。
(4)在“滤液1”中加入20﹪Na2CO3溶液,目的是__;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,原因是__。
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热。使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为__。
【答案】蓝色 NaAlO2 粉碎、搅拌、升高温度 LiCoO2可氧化盐酸,产生的Cl2会污染环境 8LiCoO2+S2O32-+22H+=8Li++8Co2++2SO42-+11H2O 调节溶液pH,使Fe3+转换为Fe(OH)3沉淀 Co2+、S2O32-也能使KMnO4溶液褪色 2CoCO3·3Co(OH)2
【解析】
电极材料的成分为LiCoO2、Al、铁的氧化物,加入NaOH溶液后,只有Al溶解,转化为NaAlO2而成为溶液A的主要成分;滤渣中含有LiCoO2及铁的氧化物,加入H2SO4和Na2S2O3,此时LiCoO2及铁的氧化物溶解,Co被还原为Co2+,Fe3+被还原为Fe2+;过滤所得滤液中加入NaClO3作氧化剂,将Fe2+氧化为Fe3+,加入Na2CO3调节溶液的pH,使Fe3+转化为Fe(OH)3沉淀;过滤出Fe(OH)3,所得滤液中加入NaF,将Li+转化为LiF沉淀;滤液中加入Na2CO3溶液,Co2+转化为钴沉淀。据此解答。
(1)观察钾元素焰色的钴玻璃,颜色为蓝色。答案为:蓝色;
(2)由以上分析知,溶液A中溶质除NaOH外,还有NaAlO2。答案为:NaAlO2;
(3)①浸取时,为提高”钴渣”中浸取率,可采取粉碎、搅拌、升高温度、适当增大硫酸浓度等措施。答案为:粉碎、搅拌、升高温度;
②工业生产中一般不用盐酸浸取“钴渣”,则表明盐酸中的Cl-可能会被氧化为Cl2,从而得出其原因是LiCoO2可氧化盐酸,产生的Cl2会污染环境。答案为:LiCoO2可氧化盐酸,产生的Cl2会污染环境;
③“钴渣”中加入H2SO4和Na2S2O3,LiCoO2溶解,+3价Co被还原为Co2+,离子方程式为8LiCoO2+S2O32-+22H+=8Li++8Co2++2SO42-+11H2O。答案为:8LiCoO2+S2O32-+22H+=8Li++8Co2++2SO42-+11H2O;
(4)在“滤液1”中的Fe3+需要除去,加入20﹪Na2CO3溶液的目的是调节溶液pH,使Fe3+转换为Fe(OH)3沉淀;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,主要是考虑某些离子的干扰作用,原因是Co2+、S2O32-也能使KMnO4溶液褪色。答案为:调节溶液pH,使Fe3+转换为Fe(OH)3沉淀;Co2+、S2O32-也能使KMnO4溶液褪色;
(5)n(H2O)=n[Co(OH)2]=![]() =0.03mol,n(CO2)=n(CoCO3)=
=0.03mol,n(CO2)=n(CoCO3)=![]() =0.02mol,从而得出1:y=0.02mol:0.03mol=2:3,y=
=0.02mol,从而得出1:y=0.02mol:0.03mol=2:3,y=![]() ,则“钴沉淀”的化学式为2CoCO3·3Co(OH)2。答案为:2CoCO3·3Co(OH)2。
,则“钴沉淀”的化学式为2CoCO3·3Co(OH)2。答案为:2CoCO3·3Co(OH)2。