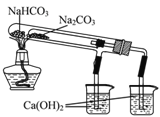
ЬтФПФкШн
ЁОЬтФПЁПФГбЇЯАаЁзщгУШчЭМЫљЪОзАжУВтЖЈТСУОКЯН№жаТСЕФжЪСПЗжЪ§КЭТСЕФЯрЖддзгжЪСПЁЃ
ЃЈ1ЃЉAжаЪдМСЮЊ________ЁЃ
ЃЈ2ЃЉЪЕбщЧАЃЌЯШНЋТСУОКЯН№дкЯЁЫсжаНўХнЦЌПЬЃЌЦфФПЕФЪЧ____________________ЁЃ
ЃЈ3ЃЉМьВщЦјУмадЃЌНЋвЉЦЗКЭЫЎзАШыИївЧЦїжаЃЌСЌНгКУзАжУКѓЃЌашНјааЕФВйзїЛЙгаЃКЂйМЧТМCЕФвКУцЮЛжУЃЛЂкНЋBжаЪЃгрЙЬЬхЙ§ТЫЃЌЯДЕгЃЌИЩдяЃЌГЦжиЃЛЂлД§BжаВЛдйгаЦјЬхВњЩњВЂЛжИДжСЪвЮТКѓЃЌМЧТМCЕФвКУцЮЛжУЃЛЂмгЩAЯђBжаЕЮМгзуСПЪдМСЁЃЩЯЪіВйзїЕФЫГађЪЧ________(ЬюађКХ)ЃЛМЧТМCЕФвКУцЮЛжУЪБЃЌГ§ЦНЪгЭтЃЌЛЙгІ________ЁЃ
ЃЈ4ЃЉBжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ__________________________ЁЃ
ЃЈ5ЃЉШєЪЕбщгУТСУОКЯН№ЕФжЪСПЮЊa gЃЌВтЕУЧтЦјЬхЛ§ЮЊb mL(вбЛЛЫуЮЊБъзМзДПі)ЃЌBжаЪЃгрЙЬЬхЕФжЪСПЮЊc gЃЌдђТСЕФЯрЖддзгжЪСПЮЊ________ЁЃ
ЃЈ6ЃЉЪЕбщЙ§ГЬжаЃЌШєЮДЯДЕгЙ§ТЫЫљЕУЕФВЛШмЮяЃЌдђВтЕУТСЕФжЪСПЗжЪ§НЋ________(ЬюЁАЦЋДѓЁБЁАЦЋаЁЁБЛђЁАВЛЪмгАЯьЁБ)ЁЃ
ЁОД№АИЁП NaOHШмвК Г§ШЅТСУОКЯН№БэУцЕФбѕЛЏФЄ ЂйЂмЂлЂк ЪЙDКЭCЕФвКУцЯрЦН 2AlЃЋ2NaOHЃЋ2H2O=2NaAlO2ЃЋ3H2Ёќ ![]() ЦЋаЁ
ЦЋаЁ
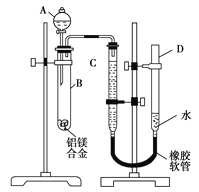
ЁОНтЮіЁПЪдЬтЗжЮіЃКЃЈ1ЃЉгЩгкBжагаЙЬЬхЪЃгрЃЌетЫЕУїМгШШЕФЪдМСВЛЪЧЫсЃЌЖјЧтбѕЛЏФјЃЌУОгыЧтбѕЛЏФЦВЛЗДгІЃЌТСгыЧтбѕЛЏФЦШмвКЗДгІЩњГЩЦЋТСЫсФЦКЭЧтЦјЁЃ
ЃЈ2ЃЉгЩгкУОТСОљЪЧЛюЦУЕФН№ЪєЃЌдкЦфБэУцгабѕЛЏФЄЃЌдђЪЕбщЧАЃЌЯШНЋТСУОКЯН№дкЯЁЫсжаНўХнЦЌПЬЃЌЦфФПЕФЪЧГ§ШЅТСУОКЯН№БэУцЕФбѕЛЏФЄЁЃ
ЃЈ3ЃЉЪЕбщЧАЪзЯШМЧТМCжавКУцЮЛжУЃЌШЛКѓМгШыЧтбѕЛЏФЦШмвКЃЌЕБВЛдйгаЦјЬхВњЩњЪБдйМЧЯТвКУцЮЛжУЃЌзюКѓНЋBжаЪЃгрЙЬЬхЙ§ТЫЁЂЯДЕгЁЂИЩдяЃЌГЦжиЃЌЫљвдЩЯЪіВйзїЕФЫГађЪЧЂйЂмЂлЂкЁЃгЩгкЦјЬхЕФЬхЛ§ЪмбЙЧПЕФгАЯьЃЌЫљвддйМЧТМвКУцЪБЛЙашвЊЪЙDКЭCЕФвКУцЯрЦНЁЃ
ЃЈ3ЃЉЧтбѕЛЏФЦШмвКгыТСЗДгІЃЌУОВЛЗДгІЃЌдђBжаЗДгІЕФРызгЗНГЬЪНЮЊ2Al+2NaOH+2H2OЃН2NaAlO2+3H2ЁќЁЃ
ЃЈ4ЃЉЧтЦјЕФЮяжЪЕФСПЪЧ![]() ЃЌдђИљОнЗНГЬЪНПЩжЊашвЊН№ЪєТСЕФЮяжЪЕФСПЪЧ
ЃЌдђИљОнЗНГЬЪНПЩжЊашвЊН№ЪєТСЕФЮяжЪЕФСПЪЧ![]() ЁЃКЯН№жаТСЕФжЪСПЪЧЃЈaЁЊcЃЉgЃЌдђТСЕФЯрЖддзгжЪСПЪЧ
ЁЃКЯН№жаТСЕФжЪСПЪЧЃЈaЁЊcЃЉgЃЌдђТСЕФЯрЖддзгжЪСПЪЧ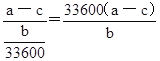 ЁЃ
ЁЃ
ЃЈ5ЃЉЪЕбщЙ§ГЬжаЃЌШєЮДЯДЕгЙ§ТЫЫљЕУЕФВЛШмЮяЃЌдђЪЃгрЙЬЬхжЪСПЦЋДѓЃЌМДcЦЋДѓЃЌЫљвдВтЕУТСЕФжЪСПЗжЪ§НЋЦЋаЁЁЃ

ЁОЬтФПЁПНЬВФжагУЫсадKMnO4ШмвККЭH2C2O4ЃЈВнЫсЃЉЗДгІбаОПгАЯьЗДгІЫйТЪЕФвђЫиЃЌРызгЗНГЬЪНЮЊЃК2MnO4Љ+5H2C2O4+6H+=2Mn2++10CO2Ёќ+8H2OЃЎвЛЪЕбщаЁзщгћЭЈЙ§ВтЖЈЕЅЮЛЪБМфФкЩњГЩCO2ЕФЫйТЪЃЌЬНОПФГжжгАЯьЛЏбЇЗДгІЫйТЪЕФвђЫиЃЌЩшМЦЪЕбщЗНАИШчЭМвЛКЭБэЃК 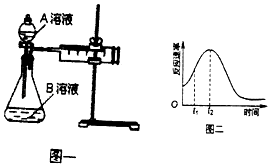
ЪЕбщађКХ | AШмвК | BШмвК |
Ђй | 20 mL 0.1 molLЉ1H2C2O4ШмвК | 30 mL 0.01 molLЉ1kMnO4ШмвК |
Ђк | 20 mL 0.2 molLЉ1 | 30 mL 0.01 molLЉ1KMnO4ШмвК |
ЃЈ1ЃЉгУЕчРыЗНГЬЪНБэЪОВнЫсШмвКЯдЫсадЕФдвђ
ЃЈ2ЃЉИУЪЕбщЬНОПЕФЪЧвђЫиЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЃЎЯрЭЌЪБМфФкеыЭВжаЫљЕУCO2ЕФЬхЛ§ДѓаЁЙиЯЕЪЧЂйЂкЃЈЬюЁАЃОЁБЁАЃМЁБЁА=ЁБЃЉ
ЃЈ3ЃЉШєЪЕбщЂйдк2minФЉЪеМЏСЫ896mL CO2ЃЈБъзМзДПіЯТЃЉЃЌдђгУMnO4ЉБэЪОИУЪБМфФкЕФЛЏбЇЗДгІЫйТЪЮЊv ЃЈMnO4ЉЃЉ= ЃЎ
ЃЈ4ЃЉГ§ЭЈЙ§ВтЖЈвЛЖЈЪБМфФкCO2ЕФЬхЛ§РДБШНЯЗДгІЫйТЪЃЌБОЪЕбщЛЙПЩЭЈЙ§ВтЖЈРДБШНЯЛЏбЇЗДгІЫйТЪЃЎ
ЃЈ5ЃЉИУЪЕбщаЁзщЭЌбЇЗЂЯжЗДгІЫйТЪШчЭМЖўЫљЪОЃЌЦфжаt1ЁЋt2ЪБМфФкЫйТЪБфПьЕФжївЊдвђПЩФмЪЧЃКЂйИУЗДгІЗХШШЁЂЂк ЃЎ
ЁОЬтФПЁП
ЙЄвЕЩЯГЃРћгУКЌСђЗЯЫЎЩњВњNa2S2O3 ЁЄ5H2OЃЌФГаЁзщЭЌбЇгУШчЯТзАжУЃЈТдШЅВПЗжМаГжвЧЦїЃЌЦјУмадвбМьбщЃЉФЃФтЩњВњЙ§ГЬЁЃЪЕбщВНжшЪЧЃКЯШЯђCжаЩеЦПМгШыNa2SКЭNa2SO3ЛьКЯШмвКЃЌдйЯђAжаЩеЦПЕЮМгХЈH2SO4ЃЛД§Na2SКЭNa2SO3ЭъШЋЯћКФКѓЃЌЙ§ТЫCжаЛьКЯЮяЃЌТЫвКОНсОЇМДЕУЕНВњЦЗЁЃ
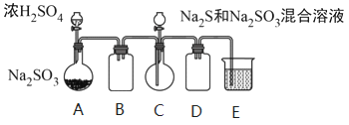
вбжЊЃКiЃЎЩеЦПCжаЗЂЩњЗДгІШчЯТЃК
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) ЃЈaЃЉ
2H2S(aq)+SO2(g)===3S(s)+2H2O(l)ЃЈbЃЉ
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) ЃЈcЃЉ
Na2S2O3(aq) ЃЈcЃЉ
iiЃЎBaS2O3взШмгкЫЎЁЃ
ЃЈ1ЃЉEжаЕФЪдМСЪЧ__________ЁЃ
ЃЈ2ЃЉЮЊЬсИпВњЦЗДПЖШЃЌгІЪЙЩеЦПCжаNa2SКЭNa2SO3ЧЁКУЭъШЋЗДгІЃЌдђЩеЦПCжаNa2SКЭNa2SO3ЮяжЪЕФСПжЎБШЮЊ__________ЁЃ
ЃЈ3ЃЉвбжЊЗДгІЃЈcЃЉЯрЖдНЯТ§ЃЌдђЩеЦПCжаЗДгІДяЕНжеЕуЕФЯжЯѓЪЧ__________ЁЃ
ЃЈ4ЃЉВњЦЗжаГЃКЌгаNa2SO3КЭNa2SO4ЁЃИУаЁзщЩшМЦСЫвдЯТЪЕбщЗНАИНјааМьбщЁЃ
ВНжш | ЪЕбщВйзї | ЪЕбщЯжЯѓ |
Ђё | ШЁЪЪСПВњЦЗХфГЩЯЁШмвКЃЌЕЮМгзуСПBaCl2ШмвК | гаАзЩЋГСЕэЩњГЩ |
Ђђ | Й§ТЫЃЌгУеєСѓЫЎЯДЕгГСЕэЃЌЯђГСЕэжаМгШызуСП__________ | ГСЕэЮДЭъШЋШмНтЃЌВЂгаДЬМЄадЦјЮЖЕФЦјЬхВњЩњ |
ЂйВНжшЂђжаМгШыЕФЪдМСПЩвдЪЧ__________ЃЈЬюађКХЃЉЁЃ
AЃЎЯЁСђЫс BЃЎЯЁбЮЫс CЃЎЯЁЯѕЫс DЃЎЧтбѕЛЏФЦШмвК
ЂкВНжшЂђЩшМЦЙ§ТЫВйзїЕФФПЕФЪЧЃЈгУЛЏбЇЗНГЬЪНМђвЊЮФзжБэЪіЃЉ__________ЁЃ
ЃЈ5ЃЉЮЊМѕЩйзАжУCжаЩњГЩЕФNa2SO4ЕФСПЃЌдкВЛИФБфдгазАжУЕФЛљДЁЩЯЖддЪЕбщВНжшНјааСЫИФНјЃЌИФНјКѓЕФВйзїЪЧ__________ЁЃ
ЃЈ6ЃЉNa2S2O3ГЃгУзїЭбТШМСЁЃNa2S2O3ШмвКгыCl2ЗДгІЕФРызгЗНГЬЪНЮЊ__________ЁЃ