题目内容
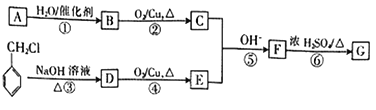
【题目】短周期元素W、X、Y、Z的原子序数依次增大,这些元素组成的单质和化合物转化关系如下图所示。其中C是淡黄色固体,B和E的水溶液均具有漂白性。下列说法不正确的是
A. 阴离子半径;Y>Z>X
B. 沸点:D<A
C. 气态氢化物稳定性:Z>Y
D. 0.1mol·L-1A溶液中:e(H-)>c(HY-)>e(Y2-)
【答案】B
【解析】由图可知:C是淡黄色固体,是硫单质,B和E的水溶液均具有漂白性,B为SO2 ,E为 Cl2,A为H2S,D为H2O,F、G为硫酸和盐酸,短周期元素W、X、Y、Z的原子序数依次增大,这些元素分别是:W-H、X-O、Y-S、Z-Cl。
A、同周期自左而右阴离子半径减小,同主族从下而上阴离子半径减小,阴离子半径:Y>Z>X,故A正确;B、D为水,水分子间形成氢键,沸点高,沸点:D>A,故B错误;C、 气态氢化物稳定性HCl比H2S稳定,即Z>Y,故C正确;D.H2S是二元弱酸,分两步电离,第二步电离更弱 0.1mol·L-1H2S溶液中:e(H-)>c(HY-)>e(Y2-),故D正确;故选B。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】利用铝锂钴废料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)回收CoO的工艺流程如下:
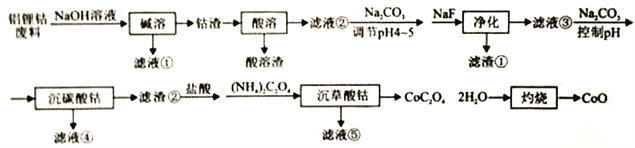
回答下列问题:
(1)“碱溶”的目的是:________________。
(2)不同浸出剂“酸溶”实验结果见下表,根据数据和物质性质应选择的浸出剂是___________(填序号),理由是__________ (用Co3O4参与反应的离子方程式表示)。
浸出剂 | 浸出液化学成分/(g·L-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCI | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+ Na2S2O3 | 84.91 | 5.96 | 98.0 |
(3)“净化”产生的滤渣为____________(填化学式),滤液③中c(F-)=4.0×10-3mol·L-1,则“净化”后残余c(Li+)=___________。LiF与Li2CO3的Ksp分别为1.8×10-3、1.7×10-3。
(4)若滤液④中含Co2+为5.9×10-2g·L-1,“沉碳酸钴"应控制pH不高于___________。Co(OH)2的Ksp为1.0×10-15。
(5)“沉碳酸钴“→“沉草酸钻”的目的是___________。
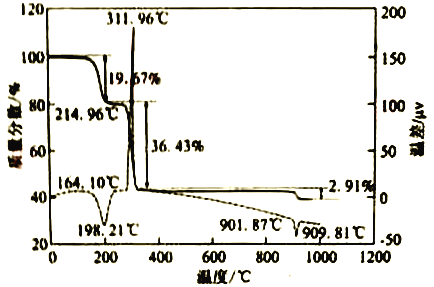
(6)CaC2O4·H2O在空气氛围中的热重曲线如下图。在311.96℃附近有个很强的放热峰的原因是______。900℃发生反应的化学方程式为___________。