题目内容
4.某研究性学习小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去).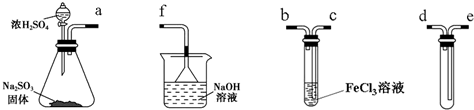
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在浓盐酸中,再加水稀释.
(2)组装仪器按气流方向正确的连接顺序是a接d,e接c,b接f.
(3)烧杯中倒置漏斗的作用是使气体充分吸收,防止溶液倒吸.
(4)往FeCl3溶液中通入足量SO2时,观察到的现象为溶液由棕黄色变为浅绿色.
(5)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式:2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;
②请设计实验方案检验有Fe2+生成:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;
③该小组同学向盛装FeCl3试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-.该做法不合理,理由是硝酸可以将溶解的SO2氧化为H2SO4,干扰试验.
分析 (1)配制氯化铁溶液时,应加相应的酸抑制铁离子水解,在烧杯中稀释配制溶液;
(2)根据实验目的,先是制备二氧化硫,然后是让二氧化硫和氯化铁之间反应,但是之前要进行防倒吸,最后进行尾气处理;
(3)倒置漏斗可防止NaOH溶液倒吸;
(4)氯化铁中通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁;
(5)①发生氧化还原反应,生成硫酸根离子、亚铁离子;
②检验有Fe2+生成,利用KSCN和氯水,先不变红,后变红分析;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性.
解答 解:(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在浓盐酸中,再加水稀释,这样操作的目的是抑制铁离子水解,故答案为:浓盐酸;
(2)根据实验目的,先是制备二氧化硫,用第一个装置,用最后一个装置,导管要短进长出,可以防止倒吸,然后是让二氧化硫和氯化铁之间反应,即第三个装置,最后进行尾气处理,顺序是:d、e、c、b、f,故答案为:d;e;c;b;f;
(3)因尾气易溶于NaOH溶液,则倒置漏斗的作用为防止NaOH溶液倒吸,故答案为:使气体充分吸收,防止溶液倒吸;
(4)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁,则观察到溶液由棕黄色变为浅绿色,故答案为:溶液由棕黄色变为浅绿色;
(5)①发生氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3++SO2+2H2O=SO42-+4H++2Fe2+,故答案为:2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;
②检验有Fe2+生成的实验方法为取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红,
故答案为:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验,故做法不合理,
故答案为:硝酸可以将溶解的SO2氧化为H2SO4,干扰试验.
点评 本题考查性质实验方案的设计及实验装置综合,为高频考点,把握装置中发生的反应及氧化还原反应原理的应用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
(1)如用如图1装置制取氨气,你所选择的试剂是浓氨水与生石灰或氢氧化钠固体等.
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中. 当悬浮物较多时,停止制备.
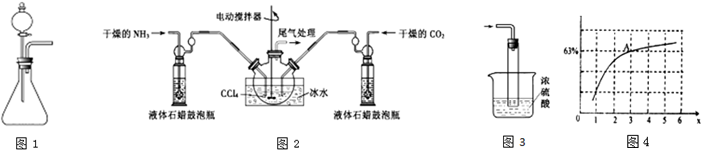
注:四氯化碳与液体石蜡均为惰性介质.
①制备氨基甲酸铵时温度不能高,该实验中控温措施有哪些搅拌、冰水浴、控制通入气体流速.
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
③尾气处理装置如右图所示.双通玻璃管的作用:防止倒吸;浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.782 0g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80.00%.
[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100]
(4)以NH3和CO2为原料在工业上生产尿素的原理是:2NH3(g)+CO2(g)?CO(NH2)(I)+H2O(I),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比),
如图4是氨碳比(x),$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x与CO2平衡转化率(a)的关系.
a随着x增大而增大的原因是NH3的量增大,平衡正向移动,则增大CO2的转化率.,图中A点处NH3的平衡转化率为42%.
 甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
则此时 V正> V逆(填“>”、“=”或“<”).
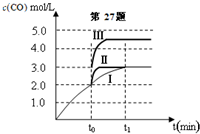
(2)在3L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
(3)一定条件下甲醇与一氧化碳反应可以合成乙酸.通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7.
| A. | 其氢氧化物中碱性最强的是LiOH | |
| B. | 离子的氧化能力最强的是Cs+ | |
| C. | 原子半径随核电荷数的增大而增大 | |
| D. | 单质的熔点随相对原子质量的增大而增大 |



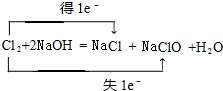 ;
;

 所示.
所示. 出发来合成M,其合成路线如下:
出发来合成M,其合成路线如下:
 .
. .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O.