题目内容
【题目】碳的化合物在生产生活和环境保护中应用广泛。
Ⅰ.碳氧化合物的综合利用
(1)利用CO可有效降低柴油发动机在空气过量条件下的NO 排放。
已知:反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-746 kJ·mol-1
N2(g)+2CO2(g) △H=-746 kJ·mol-1
反应Ⅱ:4CO(B)+2NO2(g)![]() N2(g)+4CO2(g) △H=-1200kJ·mol-1
N2(g)+4CO2(g) △H=-1200kJ·mol-1
则反应NO2(g)+CO(g)![]() CO2(g)+NO(g)的△H=__________kJ·mol-1。
CO2(g)+NO(g)的△H=__________kJ·mol-1。
在一定条件下,将NO2与CO以体积比1:2置于恒容密闭容器中发生反应Ⅱ,下列能说明反应达到平衡状态的是______________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.NO2 与CO的体积比保持不变
(2)工业上利用CO 与Cl2在活性炭催化下合成光(COCl2),反应方程式为: CO(g) +Cl2(g) ![]() COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
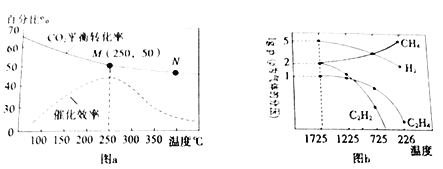
(3)利用“组合转化技术”可将CO2 转化成乙烯,反应方程式为:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
a.N点正反应速率一定大于M 点正反应速率
b.250℃时,催化剂的催化效率最大
c.M点平衡常数比N点平衡常数大
d.随着温度升高,乙烯的产率增大
Ⅱ.碳氢化合物的综合利用
利用甲烷的裂解可以制得多种化工原料,甲烷裂解时发生的反应有:2CH4(g)![]() C2H4(g)+2H2(g),2CH4(g)
C2H4(g)+2H2(g),2CH4(g)![]() C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
(4)1725 ℃时,向1L恒容密闭容器中充入0.3 molCH4达到平衡,则反应2CH4(g)![]() C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
【答案】 -227 ac 0.05 < bc 1.0×107Pa 62.5%
【解析】(1)已知:反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-746kJ·mol-1
N2(g)+2CO2(g) △H=-746kJ·mol-1
反应Ⅱ:4CO(B)+2NO2(g)![]() N2(g)+4CO2(g) △H=-1200kJ·mol-1
N2(g)+4CO2(g) △H=-1200kJ·mol-1
则反应NO2(g)+CO(g)![]() CO2(g)+NO(g)由 (反应Ⅱ-反应Ⅰ)/2得来,故该反应的△H=(-1200+746)/2= -227 kJ·mol-1;在一定条件下,将NO2与CO以体积比1:2置于恒容密闭容器中发生反应Ⅱ,该反应是气体分子数减少的反应,当a.体系压强保持不变,说明各物质的量不变,可以说明达到平衡,故a正确;b.因为该反应中,所有物质均是气体,气体总质量、总体积均不变,容器中气体密度一直不变,故b错误;c.混合气体颜色保持不变,说明NO2(g)浓度不变,故c正确; d.NO2与CO的体积比刚开始就是1:2,系数之比也是1:2,故在反应过程中NO2与CO的体积比一直保持不变,故d错误;故选ac;
CO2(g)+NO(g)由 (反应Ⅱ-反应Ⅰ)/2得来,故该反应的△H=(-1200+746)/2= -227 kJ·mol-1;在一定条件下,将NO2与CO以体积比1:2置于恒容密闭容器中发生反应Ⅱ,该反应是气体分子数减少的反应,当a.体系压强保持不变,说明各物质的量不变,可以说明达到平衡,故a正确;b.因为该反应中,所有物质均是气体,气体总质量、总体积均不变,容器中气体密度一直不变,故b错误;c.混合气体颜色保持不变,说明NO2(g)浓度不变,故c正确; d.NO2与CO的体积比刚开始就是1:2,系数之比也是1:2,故在反应过程中NO2与CO的体积比一直保持不变,故d错误;故选ac;
(2)根据反应: CO(g)+Cl2(g) ![]() COCl2(g) 在恒温条件下反应
COCl2(g) 在恒温条件下反应
起始浓度 0.1 0.1 0
反应浓度 0.075 0.075 0.075
平衡浓度 0.025 0.025 0.075
则平衡时n(Cl2)=0.025mol/L×2L=0.05mol;
设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,
由于该反应是气体分子数减小的反应,起始压强最大,若恒压条件下进行反应,相当于在反应过程中加压,平衡正向移动,平衡时CO的转化率为a2,则a1< a2;
(3)根据图像,CO2平衡转化率随温度升高逐渐下降,。a.N点温度高于M点,但催化效率低,故N点正反应速率不一定大于M点正反应速率,故a错误;b. 催化剂催化效率在M点时最大,即250℃时,催化剂的催化效率最大,故b正确;c.M点CO2平衡转化率大于N点,M点相对于N点平衡正向移动,故M点平衡常数比N点平衡常数大,故c正确;d.随着温度升高,平衡逆向移动,乙烯的产率减小,故d错误;故选bc;
(4)由图可知,在1725℃时,CH4的lg p =2,C2H4的lg p =1,C2H2的lg p =2,H2的lg p =5,故CH4的分压 p为100Pa,C2H4的分压 p为10Pa,C2H2的分压 p为100Pa,H2的分压 p为105Pa,故反应2CH4(g)![]() C2H4(g)+2H2(g)的平衡常数KP=
C2H4(g)+2H2(g)的平衡常数KP=![]() =1.0×107;在同温同体积的条件下,气体的压强之比等于气体的物质的量之比,故CH4 、C2H2、C2H4、的物质的量之比为10:10:1,根据C守恒,CH4生成C2H2的平衡转化率为
=1.0×107;在同温同体积的条件下,气体的压强之比等于气体的物质的量之比,故CH4 、C2H2、C2H4、的物质的量之比为10:10:1,根据C守恒,CH4生成C2H2的平衡转化率为![]() ×100%=62.5%。
×100%=62.5%。