题目内容
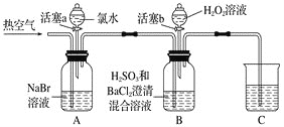
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
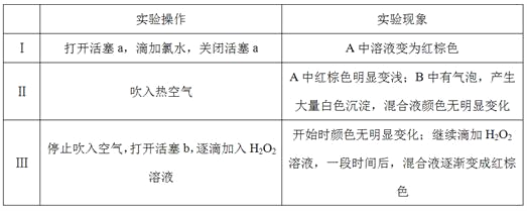
实验记录如下:
请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
【答案】2Br-+Cl2===Br2+2Cl- 吹出单质Br2 吸收尾气 NaOH溶液 H2O2+2Br-+2H+===Br2+2H2O 氧化性:H2O2>Br2>H2SO3 不干扰,无论热空气是否参加氧化H2SO3,只要观察到产生白色沉淀的同时无明显颜色变化,即能证明Br2氧化了H2SO3 H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可)
【解析】
(1)根据装置图分析A中是氯水滴入溴化钠溶液中发生的氧化还原反应,氯气氧化溴离子为溴单质;A中溶液变为红棕色;
(2)吹入热空气,根据现象分析,A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化,Br2易挥发,说明为了把A中溴单质吹到B装置中反应;
(3)装置C是尾气吸收装置,反应过程中有氯气、溴蒸气等污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收;
(4)滴入过氧化氢是氧化剂,在酸性溶液中可以把溴离子氧化为溴单质;
(5)根据氧化还原反应中氧化剂的氧化性大于氧化产物分析判断,可以得出氧化性的强弱顺序;
(6)①实验操作II吹入的热空气,无论热空气是否参加氧化H2SO3,只要观察到产生白色沉淀,同时混合溶液无明显颜色变化,即能证明Br2氧化了H2SO3;
②实验操作III,开始时颜色无明显变化的原因,H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可)。
(1)A中发生置换反应,故离子反应式为:2Br-+Cl2=Br2+2Cl-;
(2)Br2常温下呈液态,易挥发,通入热空气可促进Br2的挥发,方便吹出Br2,故答案为:方便吹出Br2;
(3)装置C吸收未反应掉的尾气;尾气可以与碱反应,因此可以用氢氧化钠溶液等碱性溶液。故答案为:吸收尾气;NaOH溶液;
(4)过氧化氢与溴离子反应生成溴单质时,混合液逐渐变成红棕色,故答案为:H2O2+2Br-+2H+=Br2+2H2O。
(5)由Ⅱ知氧化性Br2>H2SO3,由Ⅲ知氧化性H2O2>Br2,因此三者的氧化性由强到弱为:H2O2>Br2> H2SO3,故答案为:H2O2>Br2> H2SO3;
(6)①无论热空气是否参加氧化H2SO3,只要观察到产生白色沉淀的同时,无明显颜色变化,即能证明Br2氧化了H2SO3;因此吹入的热空气不干扰实验结论。
②H2SO3有剩余,双氧水先与H2SO3反应(或者H2O2浓度小或Br-与H2O2反应慢等因素都可),故答案为:不干扰,无论热空气是否参加氧化H2SO3,只要观察到产生白色沉淀的同时无明显颜色变化,即能证明Br2氧化了H2SO3;H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可)。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案