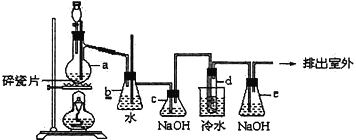
题目内容
【题目】下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
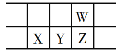
A.原子半径:W<X
B.Y单质是良好的半导体材料
C.气态氢化物热稳定性:W>Z
D.X的最高价氧化物的水化物是强碱
【答案】D
【解析】
由已知元素周期表分析,W为第二周期元素,X、Y、Z为第三周期元素,设X的最高化合价为x,则W的最高化合价为x+2,根据已知条件x+x+2=8,解得x=3,则X为Al元素,Y为Si元素,Z为P元素,W为N元素,据此分析。
A.根据周期表的原子半径大小规律:同一周期元素原子的半径随原子序数的递增而减小,同一主族元素原子的半径随原子序数的递增而增大,X元素的原子半径大于Z元素的原子半径,Z元素的原子半径大于W元素的原子半径,故X元素的原子半径大于W元素的原子半径,A正确;
B.Si是一种良好的半导体材料,B正确;
C.W的气态氢化物为NH3,Z的气态氢化物为PH3,N的非金属性大于P,故NH3的热稳定性强于PH3,C正确;
D.X元素的最高价氧化物对应点水化物为Al(OH)3,为两性氢氧化物,D错误;
故选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目