题目内容
11.Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
A.碘化氢的生成速率和分解速率相等
B.单位时间内,1molH-H键生成,同时有2molH-I断开.
C.恒容的容器中,气体密度保持不变
D.恒容的容器中,压强保持不变
E.c(H2)和c(I2)的浓度相等
F.容器内气体的平均分子量保持不变
G.容器内气体颜色保持不变
(2)根据上述实验结果,该反应的平衡常数K的计算式为:$\frac{0.10{8}^{2}}{0.78{4}^{2}}$.(用表中具体数值代入,不计算结果)
(3)上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中
k正、k逆为速率常数,则k逆为$\frac{{k}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1.
分析 (1)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(2)根据表中数据知,反应达到平衡状态时,HI的物质的量分数是0.784,碘和氢气的物质的量分数相等为0.108,其化学平衡常数K=$\frac{c({H}_{2}).c({I}_{2})}{{c}^{2}(HI)}$;
(3)根据化学平衡常数公式确定k逆、K、k正的关系;根据v正=k正x2(HI)计算正反应速率.
解答 解:(1)A.碘化氢的生成速率和分解速率相等,说明该反应达到平衡状态,故正确;
B.无论反应是否达到平衡状态,都存在单位时间内1molH-H键生成同时有2molH-I断开,所以不能据此判断平衡状态,故错误;
C.恒容的容器中,无论反应是否达到平衡状态,气体密度始终不变,所以不能据此判断平衡状态,
故错误;
D.反应前后气体计量数之和不变,所以恒容的容器中,压强始终保持不变,不能据此判断平衡状态,故错误;
E.无论反应是否达到平衡状态,c(H2)和c(I2)的浓度始终相等,所以不能据此判断平衡状态,故错误;
F.反应前后气体的计量数之和不变,气体质量不变,所以气体的平均摩尔质量始终不变,所以不能据此判断平衡状态,故错误;
G.容器内气体颜色保持不变,说明正逆反应速率相等,该反应达到平衡状态,故正确;
故选AG;
(2)根据表中数据知,反应达到平衡状态时,HI的物质的量分数是0.784,碘和氢气的物质的量分数相等为0.108,其化学平衡常数K=$\frac{c({H}_{2}).c({I}_{2})}{{c}^{2}(HI)}$=$\frac{0.10{8}^{2}}{0.78{4}^{2}}$,
故答案为:$\frac{0.10{8}^{2}}{0.78{4}^{2}}$;
(3)该反应达到平衡状态时正逆反应速率相等,v正=k正x2(HI)=v逆=k逆x(H2)x(I2),则k逆=k正.$\frac{x(HI)^{2}}{x({H}_{2}).x({I}_{2})}$=$\frac{{k}_{正}}{K}$,若k正=0.0027min-1,在t=40min时,v正=0.0027min-1×0.852=1.95×10-3min-1,故答案为:$\frac{{k}_{正}}{K}$;1.95×10-3.
点评 本题考查化学平衡状态判断、化学平衡常数有关计算等知识点,侧重考查学生分析判断能力,易错点是平衡状态判断,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,难点是(3)题计算.

| A. | 中和热(△H)的测定中,若使用简易装置时在大小烧杯之间没有垫碎泡沫塑料(或纸条) | |
| B. | 用标准盐酸滴定氢氧化钠溶液,酸式滴定管洗净后,没有用标准盐酸润洗,所测出的碱液的浓度值 | |
| C. | 食醋总酸含量测定实验中,用移液管移取食醋体积时视线俯视标准线移液 | |
| D. | 在镀锌铁皮的锌镀层厚度的测定中,锌在酸中溶解后没有及时取出 |
| A. | 蔗糖炭化 | B. | 煤的气化 | C. | 石油裂化 | D. | 氨的液化 |
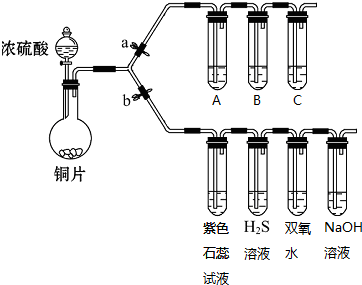
| A. | 将铁屑、溴水、苯混合制溴苯 | |
| B. | 在苯中滴入浓硝酸制硝基苯 | |
| C. | 用乙醇和乙酸混合共热制取乙酸乙酯 | |
| D. | 将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 二氧化硫 |
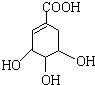
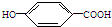 ),其反应类型是消去反应.
),其反应类型是消去反应.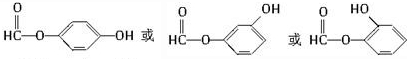
 +H2O.
+H2O.