题目内容
5.已知硫酸溶液的浓度越大密度也越大.98%的浓H2SO4的物质的量浓度为18.4mol/L,试判断49%的H2SO4溶液的物质的量浓度小于(填“大于”“小于”或“等于”)9.2mol/L.分析 设98%的浓H2SO4的密度为A,49%的H2SO4的密度为a,硫酸浓度越大,密度越大,则A>a,根据c=$\frac{1000ρω}{M}$表示出物质的量浓度,据此计算.
解答 解:设98%的浓H2SO4的密度为A,49%的H2SO4的密度为a,根据c=$\frac{1000ρω}{M}$可知,18.4=$\frac{1000A×98%}{98}$,49%的H2SO4的物质的量浓度为$\frac{1000a×49%}{98}$mol/L,硫酸浓度越大,密度越大,则A>a,故$\frac{1000a×49%}{98}$mol/L<9.2mol/L,故答案为:小于.
点评 本题考查物质的量浓度有关计算,为高频考点,明确密度、质量分数与物质的量浓度关系是解本题关键,注意:浓硫酸浓度越大其密度越大,但氨水浓度越大密度越小,为易错点.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案
相关题目
15.随着原子序数的递增,不呈周期性变化的是元素的( )
| A. | 化合价 | B. | 相对原子质量 | ||
| C. | 原子的最外层电子排布 | D. | 原子半径 |
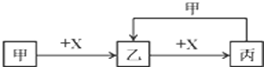
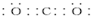 .
.
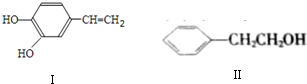
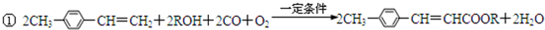
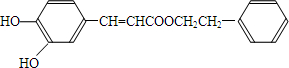 ;
;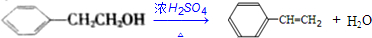 .
. 医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙为原料(含量为97.5%,含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙的主要流程如下:
医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙为原料(含量为97.5%,含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙的主要流程如下: