题目内容
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中相关的反应式为: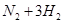


 。
。
①该反应的平衡常数K的表达式为:K=_________。升高温度,K值________(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3)。分析表中数据,__________(填温度和压强)时H2转化率最高,实际工业生产不选用该条件的主要原因是________________。

③下列关于合成氨说法正确是___________(填字母)
A. 使用催化剂可以提高氮气的转化率
B. 寻找常温下的合适催化剂是未来研究的方向
C. 由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通人空气,另一电极通入氨气。其电池反应为
你认为电解质溶液应显______性(填“酸性”、“中性”、“碱性”),写出负极电极反应式________。
(1)传统哈伯法合成氨工艺中相关的反应式为:
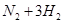


 。
。①该反应的平衡常数K的表达式为:K=_________。升高温度,K值________(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3)。分析表中数据,__________(填温度和压强)时H2转化率最高,实际工业生产不选用该条件的主要原因是________________。

③下列关于合成氨说法正确是___________(填字母)
A. 使用催化剂可以提高氮气的转化率
B. 寻找常温下的合适催化剂是未来研究的方向
C. 由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通人空气,另一电极通入氨气。其电池反应为

你认为电解质溶液应显______性(填“酸性”、“中性”、“碱性”),写出负极电极反应式________。
(12分)(1)①K= (1分) 减少(1分) ②200℃、100MPa(2分)
(1分) 减少(1分) ②200℃、100MPa(2分)
温度低速率慢,而压强太高生产设备条件难以实现(2分) ③B(2分)
(2)碱性(2分) (2分)
(2分)
 (1分) 减少(1分) ②200℃、100MPa(2分)
(1分) 减少(1分) ②200℃、100MPa(2分)温度低速率慢,而压强太高生产设备条件难以实现(2分) ③B(2分)
(2)碱性(2分)
 (2分)
(2分)试题分析:(1)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据反应的方程式可知,该反应的平衡常数K=
 。正方应是放热反应,升高温度,平衡向逆反应方向移动,所以K值减小。
。正方应是放热反应,升高温度,平衡向逆反应方向移动,所以K值减小。②根据表中数据可知,在温度为200℃、压强为100MPa时,氨气的含量最高。由于温度低速率慢,而压强太高生产设备条件难以实现,所以实际工业生产不选用该条件。
③催化剂不能改变平衡状态,只能改变反应速率,A不正确;寻找常温下的合适催化剂是未来研究的方向,B正确;根据方程式可知,该反应的熵值是减小,需要在一定条件下才能自发进行的,C不正确,答案选B。
(2)由于氨气是碱性气体,能和酸反应生成铵盐,所以电解质溶液应显碱性。原电池中负极失去电子,发生氧化反应,则氨气在负极通入,电极反应式是2NH3-6e-+6OH-=N2+3H2O。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,提升学生的学科素养。

练习册系列答案
相关题目
 2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。
2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。



 -锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
-锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。 -锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
-锂辉矿与硫酸等物质制备金属锂的工业流程如下图: