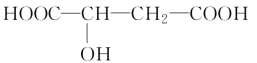题目内容
【题目】燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化-碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9kJ/mol Ea1=3.2kJ/mol
NO2(g)+O2(g) △H1=-200.9kJ/mol Ea1=3.2kJ/mol
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2=58kJ/mol
SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2=58kJ/mol
已知该体系中温度80℃以上臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:
3O2(g)。请回答:
(1)已知反应Ⅰ在低温下自发进行,则该反应的熵变△S___0(填“大于”或“小于”)。
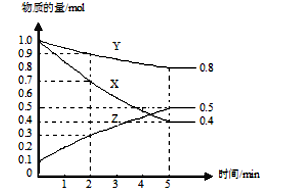
(2)其它条件不变,每次向反应器中充入含1.0molNO、1molSO2的模拟烟气和2.0molO3,改变温度,反应相同时间后体系中NO和SO2的转化率如图所示:

①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因___。
②100℃、反应相同时间t时O3的分解率达10%,则体系中剩余O3的物质的量是___mol。
③下列法正确的是___。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
(3)工业上可以通过电解NO制备NH4NO3,原理如图所示。写出电解过程阳极的电极反应式___。

【答案】小于 反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应 0.65 BCD NO-3e-+2H2O=NO3-+4H+
【解析】
(1)根据G=△H-T△S<0,反应能够自发进行,结合低温下自发进行分析判断;
(2)①反应的活化能越小,反应越容易进行;②根据图像,反应Ⅰ中NO转化率为85%,反应Ⅱ中SO2的转化率30%,2O3(g)3O2(g),发生分解反应的臭氧占充入臭氧总量的10%,据此分析计算体系中剩余O3的物质的量;③该图象中属于描点法所得图象,P点不一定为图象的最高点;温度高于200°C,臭氧分解的程度加大,体系臭氧浓度减小;若缩小反应器的容积,2O3(g)3O2(g),平衡逆向进行,臭氧浓度增大;二氧化硫属于酸性氧化物,据此分析判断;
(3)工业上电解NO制备 NH4NO3,阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,据此分析书写电极反应式。
(1)反应I:NO(g)+O3(g)NO2(g)+O2(g)△H1=-200.9kJ/mol为放热反应,即△H<0,又在低温下自发进行,根据G=△H-T△S<0自发可知,△S小于0,故答案为:小于;
(2)①反应Ⅰ:NO(g)+O3(g )NO2(g)+O2(g)△H1=-200.9kJmol-1 Ea1=3.2kJmol-1,反应Ⅱ:SO2(g)+O3(g)SO3(g)+O2(g)△H2=-241.6kJmol-1 Ea2=58kJmol-1,反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,因此,相同温度下,NO的转化率远高于SO2,故答案为:反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应;
②根据图像,反应Ⅰ:NO(g)+O3(g)NO2(g)+O2(g)△H1=-200.9kJmol-1 Ea1=3.2kJmol-1,反应中NO转化率为85%,反应的NO为0.85mol,反应的O3为0.85mol;反应Ⅱ:SO2(g)+O3(g)SO3(g)+O2(g)△H2=-241.6kJmol-1 Ea2=58kJmol-1,反应中SO2的转化率30%,反应的二氧化硫0.3mol,反应的O3为0.3mol;2O3(g)3O2(g),发生分解反应的臭氧占充入臭氧总量的10%,为0.2mol;则体系中剩余O3的物质的量=2.0mol-0.85mol-0.3mol-0.2mol=0.65mol,故答案为:0.65;
③A.该图象属于描点法所得图象,P点不一定为图象的最高点,不一定为平衡点,可能是建立平衡状态过程中的一点,故A错误;B.根据图象可知,温度高于200°C,2O3(g)3O2(g),反应进行程度加大,体系中臭氧浓度迅速减小,NO、SO2的转化率随温度升高显著降低,当臭氧完全分解,则二者转化率几乎为0,故B正确;C.其它条件不变,若缩小反应器的容积,2O3(g)3O2(g),平衡逆向进行,臭氧浓度增大,反应Ⅰ和反应Ⅱ的平衡均正向移动,NO和SO2的转化率增大,故C正确;D.根据图像,臭氧氧化过程中二氧化硫的转化率较低,不能有效地脱除SO2,二氧化硫属于酸性氧化物,可以和碱之间发生反应,后续步骤碱吸收可以有效脱硫,故D正确;故答案为:BCD;
(3)工业上电解NO制备 NH4NO3,由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,故答案为:NO-3e-+2H2O=NO3-+4H+。