题目内容
【题目】高纯无水![]() 是电解法制镁的关键原料,有化工人员开发了以菱镁矿(主要成分是
是电解法制镁的关键原料,有化工人员开发了以菱镁矿(主要成分是![]() ,含少量
,含少量![]() 杂质)为原料,以乙二醇为溶剂,采用氨络合法制备
杂质)为原料,以乙二醇为溶剂,采用氨络合法制备![]() (白色块状固体或粉末,溶于水,易潮解),再转化为无水
(白色块状固体或粉末,溶于水,易潮解),再转化为无水![]() 的新工艺,其流程图如图:
的新工艺,其流程图如图:
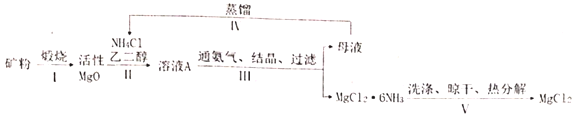
已知:①常压下,![]() 的初始分解温度为399℃,
的初始分解温度为399℃,![]() 的初始分解温度为896℃;
的初始分解温度为896℃;
②煅烧温度是影响MgO活性的关键因素;
③乙二醇的沸点197.3℃。
(1)步骤Ⅰ中工业上一般不选择800℃以上来完成这一步原因是_____。
(2)步骤Ⅱ中反应方程式为_____。
(3)步骤IV中蒸馏的目的是____。
(4)步骤V中的洗涤是为了除去晶体表面的杂质,最好选用下列哪种作为洗涤剂____。
A.氯化铵饱和溶液 B.乙二醇
C.冷水 D.氨气饱和的乙醇溶液
(5)实验过程需要测定![]() 浓度,可通过EDTA滴定(与
浓度,可通过EDTA滴定(与![]() 以1:1反应)来进行测定,若分下列步骤(未按顺序排列),为获得更可靠的实验结果,完整的操作顺序是c→___→e(用操作步骤前的字母表示)。
以1:1反应)来进行测定,若分下列步骤(未按顺序排列),为获得更可靠的实验结果,完整的操作顺序是c→___→e(用操作步骤前的字母表示)。
a.移取25.00mL待测溶液于锥形瓶中,加入10mL水,摇匀
b.用0.1000mol/L的EDTA标准溶液滴定至终点,记录消耗标准液的体积
c.称取一定质量的样品,配制250mL待测溶液
d.滴加1-2滴指示剂
e.舍弃不可靠数据、取平均值等
【答案】温度过高碳酸钙易分解、温度过高影响氧化镁的活性 ![]() 蒸馏除去母液中的水,使得乙二醇和氯化铵能循环利用 D c→a→d→b(重复“a→d→b”2-3次)→e
蒸馏除去母液中的水,使得乙二醇和氯化铵能循环利用 D c→a→d→b(重复“a→d→b”2-3次)→e
【解析】
此题是根据先将矿粉煅烧生成活性氧化镁,让活性氧化镁生成氯化镁,再利用氨络合生成MgCl2![]() 6H2O,洗涤晾干生成氯化镁,据此解答。
6H2O,洗涤晾干生成氯化镁,据此解答。
(1)由于碳酸钙高温下易分解,容易杂质,且温度过高影响氧化镁的活性,所以步骤Ⅰ中工业上一般不选择800℃以上来完成;
(2)根据工业流程中,进行氨络合反应可知,步骤Ⅱ是氧化镁和氯化铵反应,所以方程式为MgO+2NH4Cl=MgCl2+2NH3+H2O;
(3)因为步骤Ⅲ通入氨气使MgCl2转化为难溶于乙二醇的MgCl2·6NH3固体,过滤,滤液中含有可循环利用的NH4Cl和乙二醇,为防止NH4Cl受热分解,采用蒸馏去水、浓缩溶液方式得到浓度较大的乙二醇、NH4Cl的溶液,循环到步骤Ⅱ中充分利用;
(4)MgCl2·6NH3难溶于乙二醇,能溶于水,为减少洗涤过程中的损耗,不选用氯化铵饱和溶液和水洗涤,故AC不选;MgCl2·6NH3存在可逆反应:MgCl2+6NH3![]() MgCl2·6NH3,MgCl2能溶于乙二醇,选择含有氨气的饱和乙醇溶液,还能抑制MgCl2·6NH3分解,更加能减少损耗,故选D;
MgCl2·6NH3,MgCl2能溶于乙二醇,选择含有氨气的饱和乙醇溶液,还能抑制MgCl2·6NH3分解,更加能减少损耗,故选D;
(5)通过EDTA滴定(与Mg2+以1:1反应)来进行Mg2+浓度测定,为减小实验误差,重复滴定操作2~3次,取平均值进行计算,所以其实验步骤为:称取一定质量的样品→配制成溶液→移取一定量的待测液与锥形瓶→滴加1~2滴指示剂→用EDTA标准溶液滴定至终点,记录消耗标准液体积→重复滴定操作2~3次→数据处理,因此完整的操作顺序是c→a→d→b(重复“a→d→b”2~3次)→e。

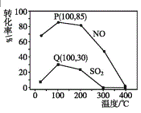
【题目】中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。下列关于KNO3的古代文献,对其说明不合理的是
选项 | 目的 | 古代文献 | 说明 |
A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,则祸不可测”——《天工开物》 | KNO3能自燃 |
B | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4);“强烧之,紫青烟起,云是硝石也”——《本草经集注》 | 利用焰色反应 |
C | 提纯 | “(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”——《开宝本草》 | 溶解,蒸发结晶 |
D | 性质 | “(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”——《本草纲目》 | 利用KNO3的氧化性 |
A.AB.BC.CD.D