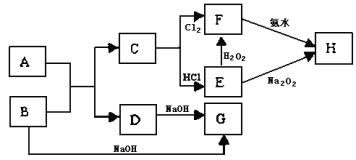
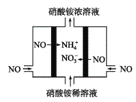
题目内容
【题目】某同学欲配制480 mL物质的量浓度为0.1mol·L-1的CuSO4溶液。
(1)完成该实验用到的仪器主要有:托盘天平、胶头滴管、烧杯、玻璃棒、药匙和____________。
(2)写出整个实验简单的操作过程:计算→称量→溶解→转移→____________→定容→摇匀。
(3)如果用CuSO4固体来配制,应该称量固体的质量为_________________;如果用CuSO4·5H2O来配制,应该称量固体的质量为____________________。
(4)下列操作使配制的溶液浓度偏低的是__________________。
A.配制的过程中有少量的液体溅出烧杯。
B.使用前容量瓶用蒸馏水洗涤,且没有干燥。
C.定容时俯视液面。
D.定容摇匀后,液面下降,又加水至刻度线。
(5)取配制好的溶液50 mL用水稀释到100 mL所得溶液中Cu2+的物质的量浓度为_________。
【答案】500mL容量瓶 洗涤 8.0g 12.5g AD 0.05mol/L
【解析】
(1)依据配制溶液的一般步骤选择需要仪器,依据配制溶液体积选择容量瓶规格;
(2)依据配制溶液的一般步骤解答;
(3)依据m=cVM计算需要硫酸铜和五水硫酸铜的质量;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 进行误差分析;
进行误差分析;
(5)根据稀释的公式c1V1=c2V2计算。
(1)实验室没有480mL的容量瓶,应该选用500mL容量瓶;故答案为:500mL容量瓶;
(2)配制500mL 0.1mol/L的硫酸铜溶液的操作步骤有:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作;故答案为: 洗涤;
(3)配制500mL0.1mol/L的硫酸铜溶液,需要硫酸铜的物质的量为:n(CuSO4)=0.1mol/L×0.5L=0.05mol,需要硫酸铜的质量为:m(CuSO4)=160g/mol×0.05mol=8.0g;需要五水硫酸铜的质量为:m(CuSO45H2O)=250g/mol×0.05mol=12.5g;故答案为:8.0g;12.5g;
(4)A、配制的过程中有少量的液体溅出烧杯,导致溶质的物质的量偏少,浓度偏小;
B、使用前容量瓶用蒸馏水洗涤,且没有干燥,对溶质的物质的量及最终溶液体积都没有影响,不影响配制结果;
C、定容时俯视观察刻度线,液面在刻度线下方,溶液的体积偏小,所配溶液的浓度偏高;
D、定容摇匀后再加水即增大了溶液的体积,故溶液浓度偏低。
故答案为:AD
(5)利用稀释公式c1V1=c2V2,0.05L×0.1mol/L=0.1L×c2,c2=0.05mol/L,故答案为:0.05mol/L。

【题目】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为______________________________;
(2)写出与H2O分子互为等电子体的微粒_________________________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是______________
A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
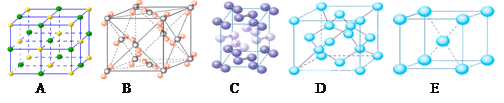
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_________(请用相应的编号填写)
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能” 是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出生成此配离子的离子方程式:__________________________________________________________。