题目内容
【题目】铝是一种很重要的金属,可以发生一系列反应制备物质。
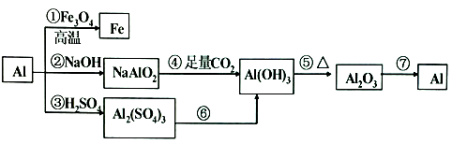
回答下列问题:
(1)反应①可以用于____________(说出一条)。
(2)②③反应产生等量氢气消耗的NaOH与H2SO4的物质的量之比为_______。
(3)反应④的离子反应的方程式为__________________。
(4)用反应⑥制备Al(OH)3,最好是向A12(SO4)3溶液中滴加______,离子方程式为________。
(5)工业上常用反应⑦制备金属铝,制备过程的方程式是_____________。
【答案】(1)焊接铁轨或冶炼金属;
(2)2:3;
(3)AlO2-+CO2+2H2O=Al(OH)3+HCO3-;
(4)氨水;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(5)2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
【解析】
试题分析:由流程可知,①为铝热反应生成Fe和氧化铝,②为Al与NaOH溶液的反应生成偏铝酸钠和氢气,③为Al与硫酸反应生成硫酸铝和氢气,④反应生成氢氧化铝和碳酸氢钠,⑤中分解生成氧化铝和水,⑦中电解生成Al。
(1)金属铝和一些金属的氧化物如氧化铁在高温下的置换反应称为铝热反应,生成的铁是液态,可以用来焊接钢轨,故答案为:焊接铁轨或冶炼金属;
(2)金属铝可以和酸以及强碱之间反应生成氢气,生成1mol氢气需要![]() molNaOH,1mol H2SO4,消耗的NaOH与H2SO4的物质的量之比为
molNaOH,1mol H2SO4,消耗的NaOH与H2SO4的物质的量之比为![]() ,故答案为:
,故答案为:![]() ;
;
(3)反应④是偏铝酸钠溶液中通入二氧化碳生成氢氧化铝的反应,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3+HCO3-;
(4)反应⑥制备Al(OH)3,最好是向A12(SO4)3溶液中滴加氨水,反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,故答案为:氨水;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(5)工业上采用电解熔融的氧化铝的方法来制取金属铝,为了降低氧化铝的熔点,可以加入冰晶石来降低其熔点,反应的化学方程式为2Al2O3(熔融)![]() 4Al+3O2↑,故答案为:2Al2O3(熔融)
4Al+3O2↑,故答案为:2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】下表是某食品包装上的说明,表中列出了部分配料。
品 名 | 乐百氏 |
部分配料 | ① 奶粉 ②白砂糖③ 乳酸钙 ④ 山梨酸钾 |
生产日期 | 标于包装封口处 |
配料中,富含蛋白质的是____(填序号,下同),属于营养强化剂的是___,属于防腐剂的是______。
