题目内容
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种: K+、Cl-、NH4+、Mg2+、Ba2+、CO3-、SO42-,将该混合物溶于水后得澄清溶液,现取3份各100mL的该溶液分别进行如下实验:

试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是________(填“一定存在”“一定不存在”或“不能确定”),根据实验①②③判断混合物中一定不存在的离子是 。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度/mol·L-1 |
(3)试确定K+是否存在并说明理由。
【答案】(1)不能确定 Ba2+、Mg2+
(2)
阴离子符号 | 物质的量浓度(mol·L-1) |
SO42- | 0.1 |
CO32- | 0.2 |
(3)K+肯定存在。由于溶液中肯定存在的离子是NH4+、CO32-和SO42-,经计算,每份溶液中NH4+、CO32-和SO42-物质的量分别为0.05mol、0.02mol和0.01mol根据电荷守恒,知道K+一定存在
【解析】
试题分析:根据题意,Ba2+和SO42-,可发生离子反应生成BaSO4↓,因此两者不能共存.Ba2+和CO32-可发生离子反应生成BaCO3↓,因此两者也不能共存。第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-。第二份加足量NaOH溶液加热后,收集到气体0.05mol,和NaOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+.故可确定一定含有NH4+,一定不存在Mg2+.根据反应NH4++OH-═NH3↑+H2O,产生NH3为0.05mol,可得NH4+也为0.05mol;第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g。部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32-+Ba2+═BaCO3↓、SO42-+Ba2+═BaSO4↓,因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解。因此溶液中一定存在CO32-、SO42-,一定不存在Ba2+。由条件可知BaSO4为2.33g,物质的量为=![]() ═0.01mol,则SO42-物质的量为0.01mol,SO42-物质的量浓度==0.1mol/L ,BaCO3为6.27g-2.33g═3.94g,物质的量为=
═0.01mol,则SO42-物质的量为0.01mol,SO42-物质的量浓度==0.1mol/L ,BaCO3为6.27g-2.33g═3.94g,物质的量为=![]() ═0.02mol,则CO32-物质的量为0.02mol,CO32-物质的量浓度为
═0.02mol,则CO32-物质的量为0.02mol,CO32-物质的量浓度为![]() ═0.2mol/L。由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+。而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol;CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.05 mol,根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.01 mol,当K+物质的量>0.01 mol时,溶液中还必须含有Cl-;当K+物质的量=0.01 mol时,溶液中不含有Cl-。
═0.2mol/L。由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+。而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol;CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.05 mol,根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.01 mol,当K+物质的量>0.01 mol时,溶液中还必须含有Cl-;当K+物质的量=0.01 mol时,溶液中不含有Cl-。
(1)依据上述分析可知Cl-可能含有,依据实验现象分析溶液中一定不含有Mg2+、Ba2+;
(2)依据上述分析计算,得到一定存在的阴离子为CO32-、SO42-,其物质的量浓度分别为:c(CO32-)=0.2mol/L;c(SO42-)=0.1mol/L;
(3)溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+.而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol;CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.05 mol,根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.01 mol,当K+物质的量>0.01 mol时,溶液中还必须含有Cl-;当K+物质的量=0.01 mol时,溶液中不含有Cl-;CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06ml,NH4+所带正电荷为0.05 mol,根据溶液中电荷守恒,可知K+一定存在;

【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧。
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A。
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B。
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5。
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体。
Ⅰ中焙烧发生的反应如下,配平并填写空缺:
FeOCr2O3 + Na2CO3 + = Na2CrO4 + Fe2O3 + CO2↑;
②Na2CO3+Al2O3=2NaAlO2+CO2↑。
(2)固体A中主要含有 (填写化学式)。
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
40 | 40.1 | 36.4 | 26.3 | 215 | |
80 | 51.3 | 38 | 73 | 376 | |
①该反应能发生的理由是 。
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、____________、____________、过滤、洗涤、干燥得到晶体。
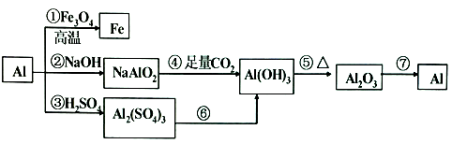
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量____________(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为____________(用含m、n的代数式表示)。