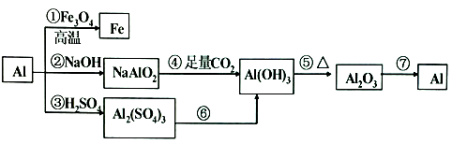
题目内容
【题目】(1)以下反应:①木炭与水制备水煤气②氯酸钾分解③炸药爆炸④酸与碱的中和反应⑤生石灰与水作用制熟石灰⑥Ba(OH)2·H2O与NH4Cl,属于放热反应__________(填序号),写出反应⑥的化学方程式______________。
(2)在下列化合物中: H2O2、Na2O、I2、NaCl、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
① 只由非金属组成的离子化合物是___________;
② 只有极性共价键的共价化合物是____________;
③ 只含有非极性共价键的是__________________;
④ 既有离子键又有非极性键的化合物是__________;
⑤ 写出NH4Cl的电子式______________;
⑥写出Na2O2的电子式______________。
(3)某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
①写出实验①中发生反应的离子方程式:_______________________。
②实验②的化学反应中转移电子的物质的量是________________。
③以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是________。
【答案】(1)③④⑤;Ba(OH)2·H2O+2NH4Cl=BaCl2+2NH3+10H2O;
(2)①NH4Cl;②CO2;③I2;④Na2O2;⑤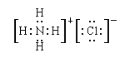 ;⑥
;⑥![]() ;
;
(3)①ClO-+2I-+2H+=I2+Cl-+H2O(2分);②0.004mol;③SO42-、I2、ClO-
【解析】
试题分析:(1)常见的放热反应有:所有的燃烧、所有的中和反应、金属和酸的反应、金属与水的反应、大多数化合反应、铝热反应等故放热反应的是③、④、⑤; 常见的吸热反应为:大多数的分解反应,氢氧化钡和氯化铵的反应、焦炭和二氧化碳、焦炭和水的反应等,所以吸热反应有:⑥,化学方程式:Ba(OH)28H2O+2NH4Cl=BaCl2 +2NH3↑+10H2O,故答案为:③④⑤;Ba(OH)28H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;
(2)①铵盐是全部由非金属元素组成的离子化合物,符合条件的是氯化铵,故答案为:NH4Cl;
②只含共价键的化合物是共价化合物,不同非金属元素之间易形成极性共价键,只有极性键构成的共价化合物为CO2,故答案为:CO2;
③同种非金属元素之间形成非极性共价键,符合条件的是I2,故答案为:I2;
④活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,则符合条件的是Na2O2,故答案为:Na2O2。
⑤NH4Cl的电子式为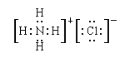 ,故答案为:
,故答案为: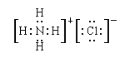 ;
;
⑥Na2O2的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)①实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原生成氯离子,该反应中,次氯酸根离子得电子作氧化剂,碘离子失电子是还原剂,氧化产物是碘,所以氧化性强弱为:ClO->I2,反应离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O,故答案为:ClO-+2I-+2H+=I2+Cl-+H2O;
②实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,氧化剂是碘,还原剂是亚硫酸钠,氧化产物是硫酸根离子,所以氧化性强弱为:I2>SO42-,反应离子方程式为:H2O + I2 + SO32- = SO42- + 2I- + 2H+,设转移电子的物质的量为x。
H2O+SO32-+I2=SO42-+2I-+2H+ 转移电子
1mol 2mol
0.5mol/L×0.004L x
x=![]() =0.004mol,故答案为:0.004 mol;
=0.004mol,故答案为:0.004 mol;
③实验①说明氧化性强弱为:ClO->I2,实验②说明氧化性强弱为:I2>SO42-,所以在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是SO42-、I2、ClO-,故答案为:SO42-、I2、ClO-。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案