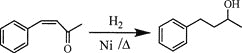
题目内容
【题目】下列装置或操作描述正确的是(必要的夹持装置及石棉网已省略)( )
A.装置①可用于实验室制乙烯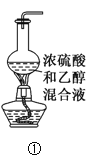
B.装置②可用于实验室制乙炔,并验证乙炔发生氧化反应
C.装置③可用于工业酒精制无水乙醇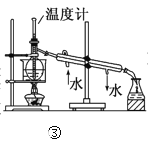
D.若A为醋酸,B为碳酸钙,C为苯酚钠溶液,装置④不能用来验证醋酸、碳酸和苯酚酸性的强弱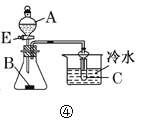
【答案】D
【解析】
A.实验室制乙烯,利用的是乙醇在浓硫酸的作用下于170℃发生的消去反应,因此反应装置中需要用到温度计,A项错误;
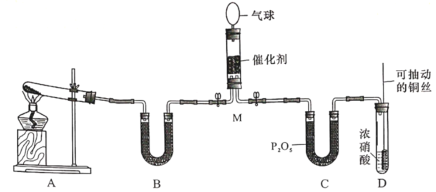
B.利用电石在实验室中制备乙炔时,由于电石与水反应十分剧烈,为控制反应速率,一般采用分液漏斗缓慢滴加食盐水的方法令二者反应;电石是块状固体,遇水后会变成粉末,因此图中采用多孔塑料板的方式无法有效阻隔电石,也就无法实现反应速率的控制;此外,利用电石与水反应制备的乙炔中含有PH3和H2S等还原性杂质,因此,在检验乙炔前,需要用硫酸铜溶液除去杂质,否则杂质会干扰乙炔的检验;
C.工业酒精是指乙醇含量大于等于95%的混合物,此时乙醇和水会形成共沸体系,蒸馏的方法无法将二者分离;因此通常采用在工业酒精中投入生石灰后,再进行蒸馏的方法获取无水乙醇,C项错误;
D.醋酸可以与碳酸钙反应生成CO2气体,可以证明醋酸的酸性强于碳酸;但由于醋酸具有挥发性,制备出的CO2中会必然含有醋酸杂质;醋酸酸性强于苯酚,能与苯酚钠反应生成苯酚,从而在较冷的溶液中引起浑浊现象;所以若不对CO2气体进行除杂,其中的醋酸杂质会产生干扰,故无法证明碳酸和苯酚酸性的强弱关系,D项正确;
答案选D。

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目