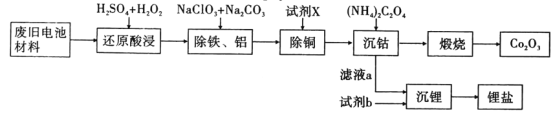
题目内容
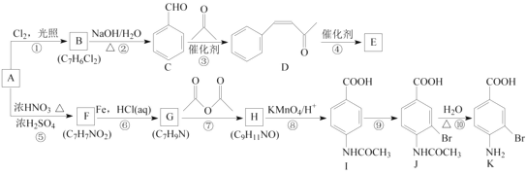
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如下图所示:
己知:①![]() ;
;
②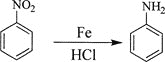
回答下列问题:
(1)A的名称是________,I含有官能团的名称是________。
(2)反应⑦的作用是________,⑩的反应类型是________。
(3)写出反应②的化学方程式:____________________________________________________。
(4)D分子中最多有________个原子共平面。E的结构简式为________。
(5)写出一种同时符合下列条件的F的同分异构体的结构简式:________。
①苯环上只有两种不同化学环境的氢原子;
②既能与银氨溶液反应又能与NaOH溶液反应。
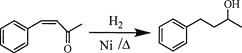
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
 ________(无机试剂及溶剂任选)。
________(无机试剂及溶剂任选)。
合成路线流程图示例如下:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
【答案】甲苯 羧基、肽键(酰胺基) 保护氨基 取代(水解)反应 ![]() +2NaOH
+2NaOH +2NaCl+H2O 19
+2NaCl+H2O 19 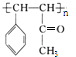
![]()
![]()
![]()
![]()
![]()
【解析】
芳香烃A与氯气在光照条件下发生取代反应生成B,B发生水解反应生成苯甲醛,结合B的分子式,可知A为![]() ,B为
,B为![]() ;对比C、D的结构可知,苯甲醛与丙酮脱去1分子水形成碳碳双键而生成D,D发生加聚反应生成高分子化合物E为
;对比C、D的结构可知,苯甲醛与丙酮脱去1分子水形成碳碳双键而生成D,D发生加聚反应生成高分子化合物E为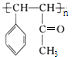 ;由I中取代基处于对位位置,可知甲苯发生硝化反应生成F为
;由I中取代基处于对位位置,可知甲苯发生硝化反应生成F为![]() ,F发生还原反应生成G为
,F发生还原反应生成G为![]() ,由I的结构简式、H的分子式可知H的结构简式为:
,由I的结构简式、H的分子式可知H的结构简式为: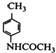 ,H被酸性高锰酸钾溶液氧化生成I,I发生取代反应生成J,J发生水解反应生成K,可知G→H是为了保护氨基,防止被氧化。
,H被酸性高锰酸钾溶液氧化生成I,I发生取代反应生成J,J发生水解反应生成K,可知G→H是为了保护氨基,防止被氧化。
(1)A为![]() ,名称是甲苯,I中官能团是羧基和肽键(酰胺基);
,名称是甲苯,I中官能团是羧基和肽键(酰胺基);
故答案为:甲苯;羧基、肽键(酰胺基);
(2)反应⑦的作用是保护氨基,防止被氧化,J发生水解反应生成K,则⑩的反应类型是取代(水解)反应,
故答案为:保护氨基;取代(水解)反应;
(3)B为![]() ,B发生水解反应生成苯甲醛,该反应方程式为
,B发生水解反应生成苯甲醛,该反应方程式为![]() +2NaOH
+2NaOH ![]()
![]() +2NaCl+H2O ;
+2NaCl+H2O ;
故答案为:![]() +2NaOH
+2NaOH ![]()
![]() +2NaCl+H2O ;
+2NaCl+H2O ;
(4)通过旋转碳碳单键,可以使苯环、碳碳双键、碳氧双键的平面共面,可以使甲基中1个H原子处于平面内,分子中最多有19个原子共平面,E的结构简式为: ;
;
故答案为:19; ;
;
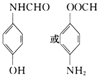
(5)一种同时符合下列条件的F(![]() )的同分异构体:①苯环上只有两种不同化学环境的氢原子,可以含有2个不同的取代基且处于对位,②既能与银氨溶液反应又能与NaOH溶液反应,含有-OOCH结构,或者含有酚羟基与醛基,可能的结构简式为:
)的同分异构体:①苯环上只有两种不同化学环境的氢原子,可以含有2个不同的取代基且处于对位,②既能与银氨溶液反应又能与NaOH溶液反应,含有-OOCH结构,或者含有酚羟基与醛基,可能的结构简式为: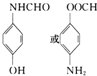 ;
;
故答案为: ;
;
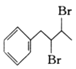
(6)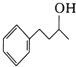 在浓硫酸、加热条件下发生消去反应生成
在浓硫酸、加热条件下发生消去反应生成![]() ,然后与溴发生加成反应生成
,然后与溴发生加成反应生成 ,最后在氢氧化钠醇溶液、加热条件下发生消去反应生成
,最后在氢氧化钠醇溶液、加热条件下发生消去反应生成![]() ,合成路线为
,合成路线为![]()
![]()
![]()

![]()
![]() ,
,
故答案为:![]()
![]()
![]()

![]()
![]() 。
。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案