题目内容
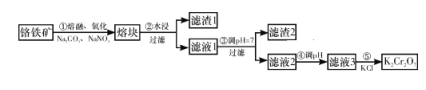
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列_____物质相似。
A 75%酒精 B 双氧水 C “84”消毒液(NaClO溶液)
(2)操作Ⅱ是根据KMnO4和K2CO3两物质在溶解度上的差异,采用_______(填操作步骤)、趁热过滤到KMnO4粗晶体的。
(3)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:_______。
(4)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:_______。
(5)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得_____mol KMnO4。
【答案】BC 浓缩结晶 2Mn2++5NaBiO3+14H+=2MnO4+5Bi3++5Na++7H2O 2MnO2+4KOH+O2![]() 2K2MnO4+2H2O
2K2MnO4+2H2O ![]()
【解析】
二氧化锰与氢氧化钾在空气中熔融,加水溶解得到K2MnO4溶液,通入二氧化碳得到KMnO4、MnO2、K2CO3,过滤除去滤渣(MnO2),滤液为KMnO4、K2CO3溶液,浓缩结晶,趁热过滤得到KMnO4晶体,母液中含有K2CO3,在母液中加石灰乳(氢氧化钙)得到碳酸钙沉淀和KOH。
(1)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故选BC;
(2)操作Ⅱ是根据KMnO4和K2CO3两物质在溶解度上的差异,采用浓缩结晶、趁热过滤到KMnO4粗晶体的;
(3)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO4-和Bi3+,则反应的离子方程式为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O;
(4)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水。反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为 2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;
2K2MnO4+2H2O;
(5)2MnO2+4KOH+O2![]() 2K2MnO4+2H2O,可知最初的原料中1mol MnO2恰好得到1mol K2MnO4.由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到
2K2MnO4+2H2O,可知最初的原料中1mol MnO2恰好得到1mol K2MnO4.由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到![]() mol KMnO4。
mol KMnO4。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案