��Ŀ����
����Ŀ��̼��������FeCO3����һ����Ҫ�Ĺ�ҵ�Ρ�ijѧϰС�����FeSO4�Ʊ�FeCO3
������ʾ��FeCO3����ɫ�ᾧ��������ˮ������Ʒ�ڿ������ȶ���ʪƷ��¶�ڿ����л����������ɺ���ɫ��ˮ��������FeO(OH��
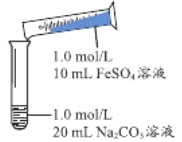
��1��ʵ��̽����
ʵ �� �� | ���� | ���� |
| 1����Ϻ���ְ�ɫ��״�����������ֳ����ʻ���ɫ�������ݲ��� 2������5-8���ӣ�����ɫ���������࣬���ձ�ɺ��ɫ |
������FeCO3���ӷ���ʽ��_________________________________��
�ڷ�Ӧ�����п�������Fe(OH)2��������__________________________________��
��ȡ�������ġ����ϴ�ӣ�������ϡ���ᣬ�����ܽ��������ݲ�����֤����ɫ�����к���CO32-����ʱ��Һ�д��ڵĽ�����������__________________________________��
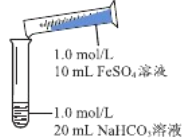
��2��ʵ��̽����
ʵ��� | ���� | ���� |
| 1����Ϻ��Թ��г��ְ�ɫ����״���ǣ�Ƭ�̺��д������ݲ��� 2����ճ�����Թ��ڱڵİ�ɫ����״���DZ����ɫ����Խ��Խ�ࣻ20���Ӻ�ɫ�������Գ��� |
�پ����飬�Թ��а�ɫ����״������FeCO3�����ϻ�ѧ�����ƽ��ǶȽ��Ͳ����������ݵ�ԭ��______________________________________________��
�ڷ���������Ϊ��ʵ������ù�����FeCO3�ĺ�����ʵ���ࡣ֧�ָý��۵IJ������������£��ֱ����ֳ������Ĺ��ˡ�ϴ�ӡ�������ȡ�����������ֹ��壬___________________����۳�����
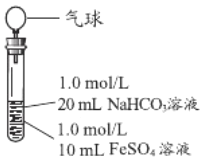
��3��ʵ��̽����
ʵ��� | ���� | ���� |
| 1����Ϻ��Թ��г��ְ�ɫ����״���ǣ�Ƭ�̺��д������ݲ��� 2��һ��ʱ����������ž��������Ľ��������Թܣ������5Сʱ���������ͣ��Թ��г�����ʼ�ձ��ְ�ɫ |
ʵ��Ľ�����ͼ��____________��
��4���ۺ�����ʵ�飬����˵����ȷ����__________
a.��NaHCO3�Ƶ�FeCO3���ȸߵ�ԭ��֮һ����ΪNaHCO3��Һ������
b.��1 L 1.0 mol/L NaHCO3������FeSO4��Һ��Ӧ�����Ͽ��Ʊ�116 g FeCO3
c.ʪƷFeCO3�ڿ����л��������ķ���ʽΪ 4FeCO3+O2+6H2O=4Fe��OH)3+4CO2
d.��ҵ����NH4HCO3��FeSO4��Ӧ���Ʊ����ȸ��ߵ�FeCO3
���𰸡� Fe2++ CO32-= FeCO3�� ��ɫ��״��ɻ���ɫ������ɺ��ɫ Fe3+ Fe2+ NaHCO3�д��ڵ���ƽ�⣺HCO3- ![]() H+ +CO32-����FeSO4 ��Fe2+ + CO32- = FeCO3 ��ƽ�����ƣ�H+ + HCO3- = CO2 ��+H2O ������ϡ����������ܽ⣬ʵ����в����������ʵ����в���������� ��Ӧ�ų�CO2������Ӧ������O2�Ļ��� a d
H+ +CO32-����FeSO4 ��Fe2+ + CO32- = FeCO3 ��ƽ�����ƣ�H+ + HCO3- = CO2 ��+H2O ������ϡ����������ܽ⣬ʵ����в����������ʵ����в���������� ��Ӧ�ų�CO2������Ӧ������O2�Ļ��� a d
�������������������1����̼����������������Ӧ����FeCO3������
��Fe(OH)2�ڿ����������ɰ�ɫ��״��ɻ���ɫ������ɺ��ɫ��
�����а�ɫ�����˵������FeCO3��������ɺ��ɫ˵������������������2����NaHCO3�д��ڵ���ƽ�⣺HCO3- ![]() H+ +CO32-����FeSO4 ��Fe2+ + CO32- = FeCO3 ����HCO3-
H+ +CO32-����FeSO4 ��Fe2+ + CO32- = FeCO3 ����HCO3- ![]() H+ +CO32-��ƽ�����ƣ�H+Ũ��������
H+ +CO32-��ƽ�����ƣ�H+Ũ��������
������̼���������ᷴӦ�ų�������̼�Ķ��ٷ�����
��3����Ӧ�ų�CO2������Ӧ������O2�Ļ�������ֹ������������
��4���ۺ�����ʵ�飬����˵����ȷ����__________
NaHCO3��Һ������������������Ũ��С��
b.��Ӧ���Ƕ�����̼���壬��1 L 1.0 mol/L NaHCO3������FeSO4��Һ��Ӧ�Ʊ�FeCO3����Ϊ0.5 mol��
c.ʪƷFeCO3�ڿ����л����������ܷų�������̼��
d. NH4HCO3��Һ����������Ũ�ȸ�С��
��������1����̼����������������Ӧ����FeCO3���������ӷ���ʽΪFe2++ CO32-= FeCO3����
��Fe(OH)2�ڿ����������ɰ�ɫ��״��ɻ���ɫ������ɺ��ɫ�����Ը��ݰ�ɫ��״��ɻ���ɫ������ɺ��ɫ���жϺ���Fe(OH)2��
�����а�ɫ�����˵������FeCO3��������ɺ��ɫ˵�����������������������ܽ����Һ�к���Fe3+ Fe2+����2����NaHCO3�д��ڵ���ƽ�⣺HCO3- ![]() H+ +CO32-����FeSO4 ��Fe2+ + CO32- = FeCO3 ����HCO3-
H+ +CO32-����FeSO4 ��Fe2+ + CO32- = FeCO3 ����HCO3- ![]() H+ +CO32-��ƽ�����ƣ�H+Ũ��������H+ + HCO3- = CO2 ��+H2O���ų�������̼��
H+ +CO32-��ƽ�����ƣ�H+Ũ��������H+ + HCO3- = CO2 ��+H2O���ų�������̼��
��̼���������ᷴӦ�ܷų�������̼�����Էų��Ķ�����̼Խ��˵������̼������Խ����
��3���Ľ�����ͼ������Ӧ�ų�CO2������Ӧ������O2�Ļ�������ֹ������������
��4���ۺ�����ʵ�飬����˵����ȷ����__________
NaHCO3��Һ������������������Ũ��С���������������������٣���a��ȷ��
b.��Ӧ���Ƕ�����̼���壬��1 L 1.0 mol/L NaHCO3������FeSO4��Һ��Ӧ�Ʊ�FeCO3����Ϊ0.5 mol����b������
c.ʪƷFeCO3�ڿ����л����������ܷų�������̼������ʽΪ12FeCO3 +3O2+6H2O = 4Fe��OH)3 + 4Fe2(CO3)3,��c������
d. NH4HCO3��Һ����������Ũ�ȸ�С�������������������������٣���d��ȷ

����Ŀ����1������Ϊ��������Ҫ������ϩ�����ƻ������顢�״������Ƽ�ȩ�ȡ�Ŀǰ���������г�������������ӵ����ơ���д���״����������Ʊ���ȩ�Ļ�ѧ����ʽ
________________________________________________________________��
��2����������ʹ�ù����У�������������ѡ���Խ��ͣ�һ��ʱ�����������ij������ʧЧ���������л��ղ�ʵ�������������������£�

��֪����������Ҫ�ɷ֣�X����ӫ�����������
Ԫ�� | Al2O3 | Ag | MgO | SiO2 | K2O | Fe2O3 |
����% | 82 | 14.8 | 1.4 | 0.9 | 0.5 | 0.1 |
���ϣ���X���������Ǽ�⣬�����������ľ���Ϊ���ͣ������ᡣ
�ٲ���a�Ͳ���b��������_________��
����д�����̢�������ϡ���ᷴӦ�����ӷ���ʽ
________________________________________________________________��
��3����Һ2 �к��ж��ֽ������ӣ��������������K+��ʵ�鷽��
____________________________________________________________________��
��4����ϻ�ѧ�����ƽ���ƶ��ǶȽ����̢����ð�ˮ���Ȼ��������ܽ��ԭ
��_______________________________________________________________��
��5�����̢������£�N2H4����Ϊ��ԭ�������в�����������ʡ���ԭ��ǿ���õ������ȸߵ��ŵ㣬�ù��̵Ļ�ѧ����ʽΪ��
________________________________________________________��
��6�����ù��̢�ʵ�������������������װ��ͼ���£�

д�����������ĵ缫��Ӧʽ��________________________________��